ブリッジレポート:(4592)サンバイオ vol.10
| (4592:東証マザーズ) サンバイオ |
|
||||||||
|
||||||||
企業名 |
サンバイオ株式会社 |
||
社長 |
森 敬太 |
||
所在地 |
東京都中央区明石町8-1 聖路加タワー28F |
||
決算期 |
1月末日 |
業種 |
医薬品(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2018年1月 | 490 | -4,378 | -3,947 | -3,940 |
| 2017年1月 | 949 | -1,932 | -2,166 | -1,835 |
| 2016年1月 | 1,174 | -1,125 | -1,172 | -988 |
| 2015年1月 | 3,229 | 2,248 | 2,228 | 1,736 |
| 2014年1月 | 204 | -584 | -587 | -589 |
| 株式情報(4/24現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
【沿革】
麒麟麦酒株式会社(現 キリンホールディングス)で研究開発を行っていた森 敬太氏(サンバイオ株式会社 代表取締役社長)は、自ら新しい事業に挑戦したいと考えていたところ、旧知の友人で、大手コンサルティング会社ボストンコンサルティング・グループのコンサルタントを経て、製薬企業向け営業支援を行う(株)ケアネット(2150、東証マザーズ)の創業に携り同社副社長であった川西 徹氏(サンバイオ株式会社 代表取締役会長)と、起業に関して意気投合した。将来の方向性など様々な議論を行うなか、2人とも大学時代に農学部でバイオテクノロジーを専攻していたこともあり、「バイオの世界で、新しい分野、新しい市場を創り出す」ことに目標を定めた。具体的な分野として将来性の大きい「再生細胞薬」に注目し、その製品化・事業化を目指して、2001年2月、SanBio, Inc.を米国カリフォルニア州に設立した。 創業にあたり、慶應義塾大学 岡野栄之(ひでゆき)教授(脳神経領域の再生医療、iPS研究で世界の第一人者。現在、慶應義塾大学大学院医学研究科委員長、日本再生医療学会理事ほか)の研究分野に着目し、協力を願い出たところ快諾を得て、同氏の紹介もあり、2002年12月、神奈川県内の国公私立大学の研究成果を企業に橋渡しする技術移転機関「よこはまティーエルオー株式会社」から、現在の開発品の基本技術となっている基本シーズに係る知的財産の譲渡を受けた。岡野氏は創業科学者としてサンバイオの創業以来、科学的な見地からのアドバイスを提供している。一方、米国では、再生医療分野での強力なネットワークを通じて、各分野の有力なアドバイザーや、優秀な研究員を獲得し、再生細胞薬の開発、製造及び大量生産技術の確立を進めてきた。 サンバイオは、同社の開発する再生細胞薬の開発・販売について、大手製薬会社との提携を模索していたが、2009年12月に再生細胞薬「SB623」の日本における脳梗塞用途の開発専用実施権許諾契約を帝人株式会社と締結。翌2010年5月には脳梗塞について、米国食品医薬品局(Food and Drug Administration以下、FDA)から臨床試験開始の承認を取得した。一方、2010年9月には大日本住友製薬株式会社と米国及びカナダにおける脳梗塞用途のオプション契約を締結。 2011年1月には米国において「SB623」の慢性期の脳梗塞を対象とした臨床試験(フェーズ1/2a)を開始し、2013年8月には被験者18名に「SB623」の投与を完了し、SB623の安全性と統計学的に有意な有効性データが確認された。 2012年12月に京都大学の山中伸弥教授がiPS細胞の開発でノーベル賞を受賞したことに加え、2014年11月に改正薬事法及び再生医療新法が施行され、再生医療等製品について早期承認制度がスタートしたのを契機に、再生医療分野での日本の存在価値が世界的に急速にクローズアップされるなか、これを絶好の機会と捉え、日本を経営の中心に米国を研究開発の拠点に世界的な事業展開を図るべく、2013年2月、日本にサンバイオ株式会社を設立。2014年1月には、サンバイオ(株)を親会社、米国のSanBio, Inc.を完全子会社とする企業再編を行い、2015年4月東証マザーズ市場に上場を果たし、日本におけるバイオベンチャーIPOとしては最大規模の73億円を調達した。 【サンバイオグループと開発体制】
沿革で触れたように、同社グループは、サンバイオ株式会社とその連結子会社SanBio. Inc.(米国カリフォルニア州)の2社から構成されている。再生細胞薬の研究開発については、2001年の創業以来一貫して、米国SanBio, Inc.の世界最高の開発・製造チームが中心になって手掛けているが、世界を見据えた事業展開を視野に、現在日本においても開発体制の拡充を進めている。 【企業理念】
慢性期(※1)脳梗塞、外傷性脳損傷、加齢黄斑変性、網膜色素変性、パーキンソン病、脊髄損傷、アルツハイマー病等のアンメットメディカルニーズ(※2)の高い疾患を対象に再生細胞薬による治療法を確立することで、世界中のこれら疾患を抱えた患者の治療・身体機能の改善に寄与することをグループのミッションとしている。
※1 慢性期:同社では、脳梗塞や外傷性脳損傷において、発症もしくは受傷後6か月あるいは6か月以上が経過したものを慢性期と定義している。
※2 アンメットメディカルニーズ:未だ有効な治療法がない治療ニーズ。  【同社を理解する上でのポイント】
同社の事業内容を理解するには、細胞、脳の再生、再生医療など知っておくべきポイントがいくつかある。
<細胞>
<脳の再生>
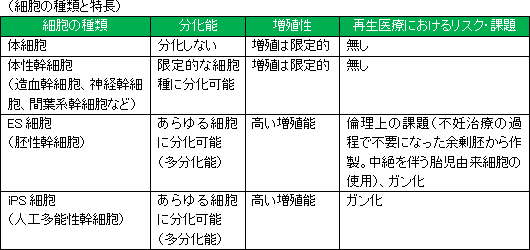
<ES細胞・iPS細胞 対 間葉系幹細胞(MSC)>
 <再生医療>
再生医療とは、損傷を受けた生体の機能を、細胞や、細胞外マトリクスや成長因子などを用いて復元または活性化させる医療。具体的には、患者に患者本人若しくはドナーの幹細胞を移植し、目的の細胞に分化したり、既存の細胞に作用したりすることで疾患を治療するもので、従来はなし得なかった根本的な治療を可能にすると言われている。
①再生医療とは ②世界が注目する日本の事業環境
経済産業省の資料によると、2012年に国内90億円、海外1,000億円だったと推計される再生医療市場は、2050年にそれぞれ2.5兆円、38兆円規模に拡大する見込み。2006年、2007年に山中教授がiPS細胞に関する画期的な成果を上げる一方で、米国では2009年3月にオバマ大統領が、ブッシュ政権が禁じていたES細胞への連邦政府助成を解禁する法案に署名するなど再生医療における研究競争が激化する中、日本では「激化する研究競争を勝ち抜き、患者のための臨床技術とするためには、産学官が一体となった強力な体制が必要不可欠」(「再生・細胞医療の現状及び課題 2012年9月26日 厚生労働省 医政局研究開発振興課」より)との認識が強まり、「再生医療」は日本再興戦略の重要テーマの一つとして掲げられることとなった。 そうした動きに応じて、2014年11月25日には医薬品医療機器等法(薬事法が改正・名称変更された。以下、改正薬事法とも使用)や再生医療等安全性確保法が施行され、再生医療の承認に向けた法体系が確立された。特に、改正薬事法に導入された早期承認制度においては、これまで5~8年かかった臨床試験から承認までの期間が3年半と短くなった。また、再生医療等安全性確保法においては細胞培養加工の外部委託が認められたことも極めて画期的で、多くの海外企業がアライアンス等を通じて日本での事業開始を表明するなど、日本の再生医療を取り巻く環境は世界が注目するところとなっている。 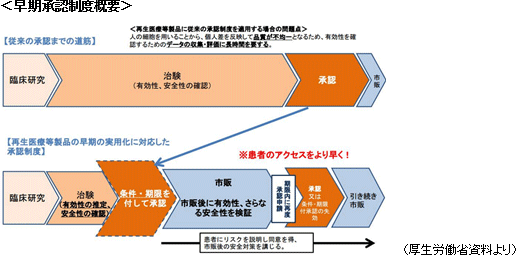 【事業内容とビジネスモデル】
主に脳神経に係る疾患である、慢性期脳梗塞、外傷性脳損傷、加齢黄斑変性、網膜色素変性、パーキンソン病、脊髄損傷、アルツハイマー病等のアンメット・メディカル・ニーズの高い疾患を対象とした再生細胞薬の開発、製造、販売を手掛けている。
<再生細胞薬>
同社グループは上記疾患を対象とした再生医療において、「再生細胞薬」の投与による治療を目指している。①再生細胞薬とは サンバイオの再生細胞薬は、患者自身の細胞の再生機能を高め、病気・事故等で失われた身体機能の自然な再生プロセスを誘引ないし促進させ、運動機能、感覚機能、認知機能を回復させる効能が期待される医薬品である。 ②他家移植 対 自家移植
再生医療に使用される細胞としては、「自家(じか)移植」と「他家(たか)移植」の2種類がある。「自家移植」は患者本人から細胞を採取して加工・培養し、元の患者に移植し、治療するもの。これには、移植細胞の生着と栄養分を送るための血液供給機構が必要となる。さらに必要に応じて調製、加工、培養される。 「自家移植」による再生医療としては、前述のテルモの骨格筋芽細胞シートがこれにあたる。 患者の大腿部より筋肉組織を採取。組織内に含まれる骨格筋芽細胞を培養してシート状にし、そのシートを元の患者の心臓表面に移植することにより、重症心不全の病態改善が期待できるというもので、培養する細胞は患者自身から採取する自家細胞のため、理論的には免疫拒絶反応がないことが特徴として挙げられる。しかしながら、自家培養であっても、培養に使用される材料によっては免疫反応が起こる場合もあるという。自家移植は一般的に、「細胞調製に時間と手間がかかる」、「個人間のばらつきが大きい」などの点が指摘される。 他方、「他家移植」の場合は、健康なドナーから採取した細胞を加工・培養して量産化する。一人のドナーから数千人分の治療薬を製造することが可能であるため、自家移植に比べて、より低コストで治療できる。「他家移植」は、安全性および免疫適合性の問題をクリアできれば、多くの疾患に対する再生医療としてより良い選択肢となる。 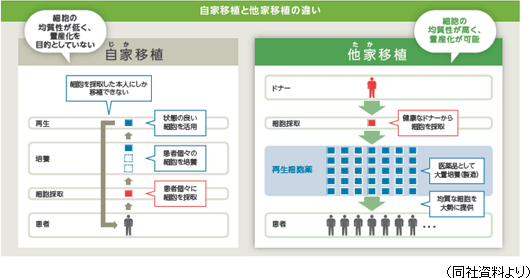 同社グループのミッション『再生細胞薬を用いて世界中のアンメット・メディカル・ニーズの疾患を抱えた患者の治療・身体機能の改善に寄与する。』を実現するためには、「医薬品」として大量に生産し、既存の物流に乗せて世界中に届けることができる「他家移植」を採用している。 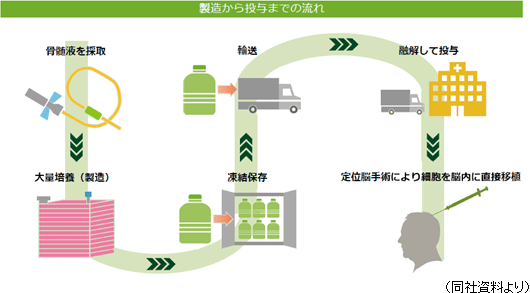 ③量産化について
再生細胞薬の実用化にあたっては、量産化技術の確立がカギを握るが、サンバイオはすでにその点をクリアしている。
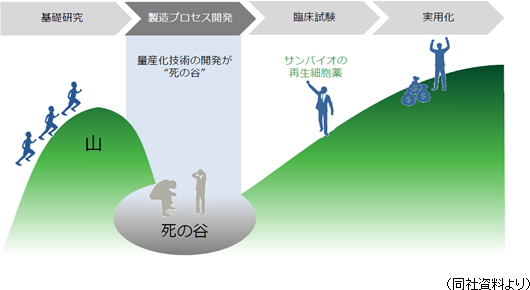 しかしながら、再生医療関連企業で量産化まで技術を確立できている企業は非常に少ない。従来の薬に比べて構造が複雑なものを取り扱う再生医療ビジネスにおいては、実用化に至るまでに長い年月が必要で「量産化」という超え難い「死の谷」が存在する。同社は、その「死の谷」をすでに超えているという点で、他社を大きくリードしていると言えよう。 「SB623」の臨床試験が着実に進展する中、2018年3月には日立化成株式会社(4217、東証1部)グループと「SB623」の製造に関する業務提携を締結した。 日立化成の子会社で再生医療等製品の受託製造事業を行うHitachi Chemical Advanced Therapeutics Solutions, LCCが保有する製造施設で、日本と米国市場向けに「SB623」の後期臨床試験用及び市販用製品を製造する。 ④再生細胞薬「SB623」
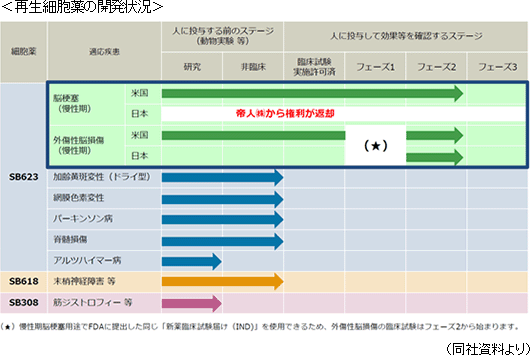
現在は、「SB623」の慢性期の脳梗塞および外傷性脳損傷を対象とした開発が最も進んでいる。当面は、「SB623」の適応疾患拡大に注力する模様だが、将来的には、「SB623」のほか、「SB618」や「SB308」といった異なる機能を持った細胞薬の開発も進めていく。
  (1)「SB623」の効能
「SB623」は神経機能を再生する作用を持つ可能性を持つ治療薬で、体の自然な再生プロセスを促進させ、病気やケガで失われた運動機能、感覚機能及び認知機能の再生を目標としている。具体的な発現作用としては、①神経細胞をまもる、②神経細胞をつくる、③血管をつくる、④炎症を抑える等があり、これまでの研究によると、これらが複合的に作用することが示唆されている。「SB623」の現在の中心的な対象疾患である脳梗塞は、脳の血管が詰まることで、その先の神経組織に栄養が届かなくなり、細胞が機能を失ったり死んでしまう病気である。脳梗塞は、発作後数時間までの急性期には血栓溶解剤も有効だが、それを過ぎるとリハビリ以外に対処方法はなく、さらに6~12か月を過ぎた慢性期に入ると多くの場合、リハビリによる改善効果も期待できないと言われる。 同社グループでは、米国で2011年から慢性期の脳梗塞患者に対して、2年間の「SB623」の安全性と有効性を確認するためのフェーズ1/2a臨床試験(フェーズ1とフェーズ2の一部を同時に行い、再生細胞薬の安全性と有効性を同時に確認したため、フェーズ1/2aとしている。)を実施し、2014年2月に最後の投与患者の投与後6か月の効果測定が完了した。この結果、副作用は認められないこと(安全性)、脳梗塞患者の運動機能が改善したこと(有効性)が確認され、FDAの承認の下、2016年よりフェーズ2bを実施し、2017年12月に被験者の組入れを完了している。 (もう一つの対象疾患である外傷性脳損傷についても2018年3月に組入れ完了。) 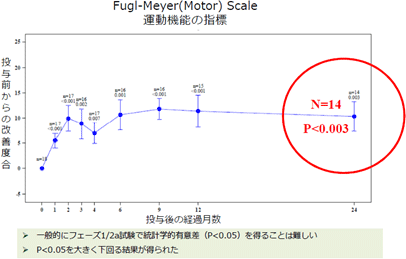 今回開示されたグラフでは、運動機能の改善が投与後24か月後も維持されていることが確認された。  https://www.youtube.com/watch?v=E4WXwhTp7Ow&end=215 (2)「SB623」の投与方法
投与方法は、慢性期脳梗塞の場合、定位脳手術と呼ばれる既に脳神経外科では広く普及した手技により、局所麻酔で安全に投与される。
 (3)開発の進捗
2014年6月、米国において「SB623」のフェーズ1/2a臨床試験の結果を受けて、FDAから次のフェーズ2bの臨床試験実施承認を取得したのを機に、同年9月には、大日本住友製薬株式会社が先に締結したオプション契約を行使し、米国及びカナダにおける「SB623」の脳梗塞用途の共同開発をスタートした。◎慢性期脳梗塞 フェーズ1/2aの2年間の経過観察期間が2015年8月に終了し、次のフェーズ2bへ進むに当たり、2015年9月には最初の治験施設との契約締結により共同開発パートナーである大日本住友製薬からマイルストン収入5百万米ドルを受領した。 2015年12月には、「脳梗塞発症後6か月から5年が経過した運動機能障害がある慢性期の患者」を対象にフェーズ2b(被験者数156名、二重盲検試験)の被験者募集を開始し、2016年3月8日には最初の被験者の組入れを実施した。これにより大日本住友製薬から5百万米ドルのマイルストンを受領した。 2017年6月、フェーズ2b試験に対しカリフォルニア州再生医療機構より、総額20百万米ドルの補助金を獲得し、開発の進捗に応じて、補助金を受領することになった。2018年3月までに18百万米ドルを受領済である。 同社では、2018年3月までにフェーズ2bにおける被験者156名の組入れ完了を目指していたが、約3か月前倒しとなる2017年12月に、予定を上回る163名の組入れを完了した。 今後は、12か月の経過観察および解析期間を経て、2020年1月期前半の結果公表を予定しており、その後、最終段階となるフェーズ3へと進む計画だ。 一方、日本における慢性期脳梗塞プログラムの開発については、開発権及び販売権を帝人(株)にライセンスアウトしていたが、「SB623」に対する患者の期待の声がますます強まる中、両社協議の結果、開発および上市を更にスピードアップさせるためにはサンバイオが単独で取り組むことが適当であるとの判断に至り、2018年2月付で両権利がサンバイオに返還された。 サンバイオは独自開発の準備に着手し、日本の早期承認制度を利用して慢性期脳梗塞治療薬として世界中で最初の販売承認取得を目指す。 ◎外傷性脳損傷
「SB623」の疾患ターゲットとしては慢性期脳梗塞にとともに外傷性脳損傷用途の開発も着実に進んでいる。外傷性脳損傷は、交通事故や転倒などで頭に強い衝撃が加わり脳が傷つくことによって起こる疾患で、半身の麻痺や感覚障害、記憶障害等の他、行動や感情のコントロールが困難になる高次脳機能障害といった深刻な後遺症が残る。改善を期待できる期間は脳梗塞よりもやや長いものの損傷後半年から1年程度にとどまり、それを超えると有効な治療法が存在しないとされている。なお、米国で救急受診する患者数は年間約250万人で、後遺障害を抱える人の数は米国だけでも530万人に上ると推計されている。 米国での臨床試験について、外傷性脳損傷は、損傷部位や症状が脳梗塞に似ているほか、SB623の投与方法も同様であることから、SB623の適応疾患としてフェーズ1をスキップし、フェーズ2から治験を開始することで2015年4月にFDAと合意し、承認を取得した。 外傷性脳損傷を対象としたフェーズ2は、「外傷性脳損傷受傷後12か月以上が経過した運動機能障害がある慢性期の患者」を対象とした日米グローバル治験として、日米約40施設の施設で、米国では2016年7月に、日本では2016年10月に最初の被験者の組入れを実施。被験者数52名(二重盲検試験)の組入れを目指して進めてきたが、2018年3月に予定を上回る61名の組入れを完了した。 今後は、6か月の経過観察および解析期間を経て、今期2019年1月期中の結果公表後、日本では来期2020年1月期中に条件付き早期承認制度への申請を予定しており、「SB623」として最初の販売承認取得を目指す。米国では最終段階となるフェーズ3へと歩を進める。 ◎加齢黄斑変性
「SB623」は強い神経保護作用を持つと考えられることから、網膜疾患への適応可能性が期待されている。黄斑(おうはん)とは網膜の中央にあり、ものを見るために一番重要な部分。ものの形、大きさ、色、立体性、距離などの光の情報の大半を識別している。加齢とともに徐々に網膜の細胞が死滅する結果、視力が低下したり、ものの見え方に支障が出るのが加齢黄斑変性症である。そのなかでも患者数の多いドライ型については、根本的な治療法が存在しない。 患者数が多く、新たな治療法の確立が待たれている同疾患に対して、同社は、特に加齢黄斑変性(ドライ型)および網膜色素変性をパイプラインに入れ開発を進めている。 同社では、網膜変性の動物試験(非臨床試験)の結果をもとに、2014年1月に、FDAとINDミーティング(新薬の臨床試験申請前の情報提供)に向けた事前ミーティングを実施した。現在は今後米国で臨床試験を実施するために必要な非臨床試験の追加データについて準備を進めている。 <ビジネスモデル>
大学等の研究機関から技術を取得して同社が製造開発、非臨床試験、臨床試験を実施し、医薬品の販売網を有するパートナー製薬会社に開発権及び販売権をライセンス許諾する。契約に応じて、①契約一時金、②マイルストン収入、③開発協力金、④ロイヤルティ収入、⑤製品供給に係る収入等を得るビジネスモデルとなっている。①概要 技術導入、研究開発・試験、製品製造については、委託先である大学等研究機関、研究受託機関、製造受託機関等に対し適宜委託費用を支払う。なお、ライセンス許諾については、ヒトでの安全性と有効性を確認する段階まで自社で開発を進めたうえで検討するとしており、製品価値の最大化を目指している。 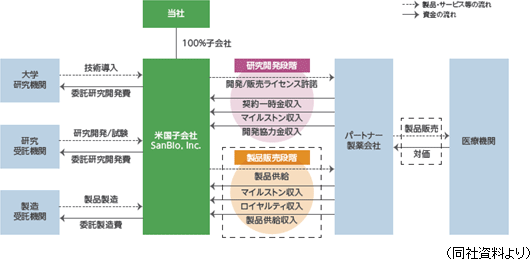  収入は、開発段階においては、①契約一時金収入、②マイルストン収入、③開発協力金収入のいずれか、またはすべてで構成され、製品上市後は、売上マイルストンに関する②マイルストン収入、④ロイヤルティ収入、⑤製品供給収入が主な収入形態となる。④ロイヤルティ収入、⑤製品供給収入は製品売上の一定割合として支払われるため製品売上に比例して増加することとなる。 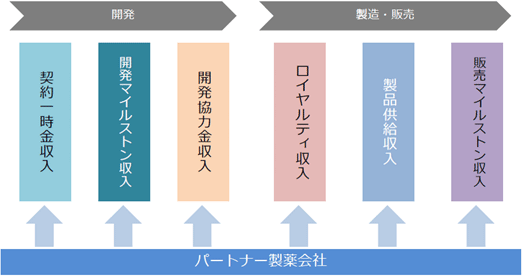 ②パートナー製薬会社との提携状況
北米における「SB623」の脳梗塞用途の開発、製造、販売についてはパートナー製薬会社として、大日本住友製薬株式会社と契約を締結している。
  【特徴と強み】
①巨大なターゲットマーケット
同社の再生細胞薬の対象となる疾患は、世界的に旧来の医療では対応できなかった中枢神経系領域が中心であるため、対象患者数が多いことが見込まれる。脳卒中患者数は米国においては約660万人と言われている。日本では、厚生労働省「2014年 患者調査」(2015年12月発表)によれば、2014年の脳血管疾患(脳卒中)総患者数は推計で118万1千人。おおよそ国民の100人に1人という割合となっている。 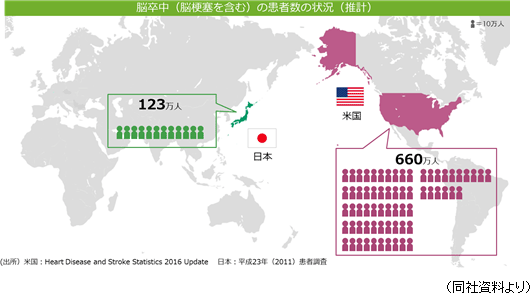 後者2疾患の総患者数は脳卒中よりも少ないが、特にアルツハイマー病の患者数は近年急速に増加しており、有効な治療法に対するニーズは高まっている。 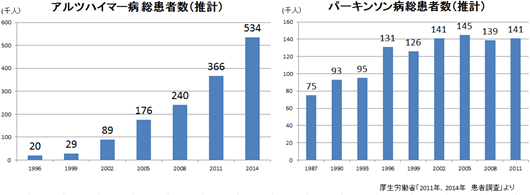 ②競争優位性を高める特許戦略
開発及び製品販売に伴う収入の極大化を目指すため、再生細胞薬の開発に必要な知的財産を全て自社で取得することを特許戦略の基本方針としており、開発を進めている再生細胞薬(SB623、SB618、SB308)の基本特許は全て取得済みだ。現在、以下の様に主要市場全てで基本特許を取得済みであり、地域ごとの特性を考慮して、自社単独もしくは有力なパートナー製薬企業との契約締結も検討しつつ、世界各地における臨床試験、製造開発、製品販売に向けた基盤の整備を進めていく考えだ。 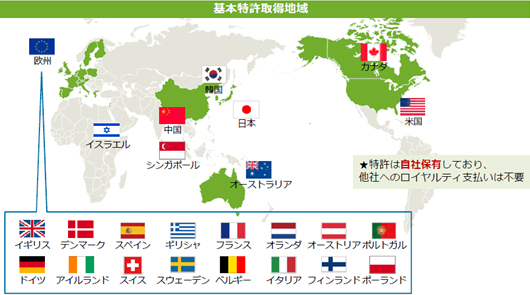 このうち物質特許は物質そのものを保護する特許で、医薬品の特許のなかで最も重要で権利範囲の広い特許として取得に大きな費用と時間が必要になる。物質特許を取得できれば、開発した医薬品を独占的に製造・販売することができるため、同社グループでは「物質特許」の取得に最も力を注いでいる。 ③製品供給権を確保
他社からライセンス導入して研究開発を行う創薬ベンチャー企業の場合、多くはパートナー製薬会社が製造を担い創薬ベンチャー自らが製品供給権を保有していないため、製品販売後の売上は製品販売に伴うロイヤルティ収入のみとなってしまう。これに対し同社の場合、再生細胞薬は、他社からのライセンス導入品ではなく、基礎段階から自社で研究開発を行ってきた独自製品である。そのため、パートナー製薬会社との関係においては、再生細胞薬の製造を同社が担うため、製品販売後は製品販売に伴うロイヤルティ収入に加え、製品供給の対価として製品供給収入も獲得することが可能であり、収益源がより多角化している点も注目される。 ④確立された量産化技術&再生細胞薬の安全性
再生細胞薬は、健常者ドナーの骨髄液から採取した細胞に、神経再生能力を高めるため遺伝子を導入(一過性)し、それを大量に増殖して作られている。
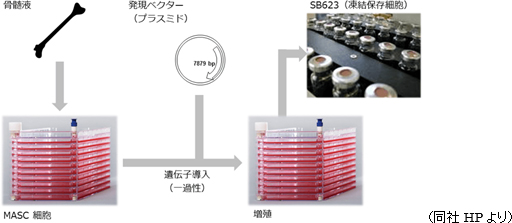 また、倫理上の問題を指摘されるES細胞や、がん化リスクのあるiPS細胞に比べ安全性が高いと考えられる点からも、臨床現場から受け入れられやすいと想定できることも同社の差異化要因である。 |
| 2018年1月期決算概要 |
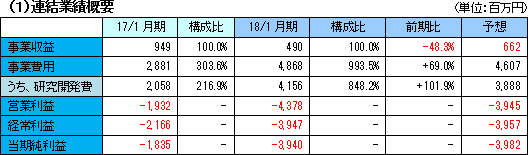 計画通り治験が進展。ほぼ想定通りの着地。
事業収益は、前期比48.3%減の4億90百万円。内容は、北米において大日本住友製薬株式会社と締結している「SB623」の共同開発及びライセンス契約による開発協力金収入。引き続き治験が進展し、研究開発費はやや計画を上回り、前期比101.9%増加の41億56百万円。営業損失は43億78百万円と前期よりも拡大したが、ほぼ計画通りに着地した。 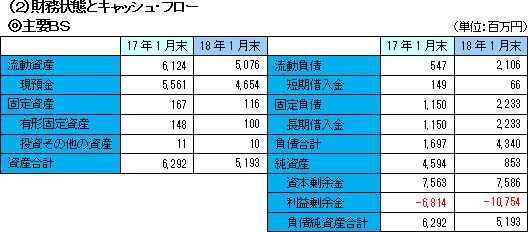 利益剰余金のマイナス幅拡大で純資産は同37億41百万円減少し8億53百万円となった。 この結果自己資本比率は前期末の72.8%から56.7ポイント低下し、16.1%となった。 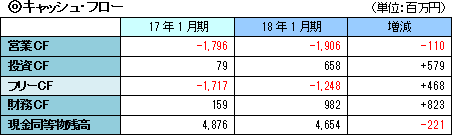 定期預金の払戻で投資CFのプラス幅は拡大した。 長期借入金の増加で財務CFのプラス幅は拡大。 キャッシュポジションは低下したが、開発資金は十分に確保されていると会社側は考えている。 (3)トピックス
前述のように、慢性期脳梗塞(米国)のフェーズ2b、外傷性脳損傷(日米グローバル)のフェーズ2臨床試験の患者組入れが完了し、前者は来期2020年1月期前半の、後者に関しては今期中の結果公表を予定している。
①治験の進捗状況 ②市販後体制構築に着手
「SB623」の臨床試験が着実に進展する中、市販後体制構築を見据え、2018年3月に日立化成株式会社(4217、東証1部)グループと「SB623」の製造に関する業務提携に合意した。日立化成の子会社で再生医療等製品の受託製造事業を行うHitachi Chemical Advanced Therapeutics Solutions, LCC(HCATS)が保有する製造施設で、日本と米国市場向けに「SB623」の後期臨床試験用及び市販用製品を製造する。 日立化成は、2017年5月に再生医療等製品の受託製造の分野で米国大手の1社であるHCATS を完全子会社化し、2018年4月には神奈川県横浜市にグローバルで3拠点目となる再生医療等製品の製法開発・受託製造施設の稼働を開始するなど、再生医療製品製造事業の拡大に注力している。 サンバイオは、日立化成グループの製品品質の高さ、安定供給力を評価し、今後のグローバル展開を見据えた結果、今回の合意に至った。 ③資金調達について
慢性期脳梗塞を対象としたフェーズ2b臨床試験に対して、カリフォルニア州再生医療機構(CIRM)から総額20百万米ドルの補助金を獲得しているが、現在までに患者組入れ100%完了分の補助金までを含む総額18.0百万米ドルを受領している。
◎カリフォルニア州再生医療機構(CIRM)からの補助金収入 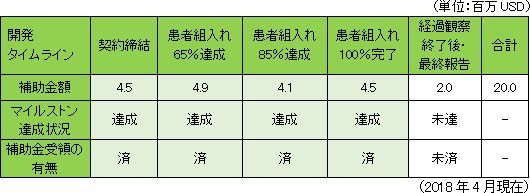 ◎新株予約権による約150億円の資金調達
これまで既存の慢性期脳梗塞プログラムに関する資金については、大日本住友製薬からの開発マイルストン収入や開発協力金等およびCIRMからの補助金によって賄い、外傷性脳損傷プログラムに関しては上場時の調達資金に加え、銀行2行とのコミットメント契約に基づく借入金等によって賄ってきたが、両プログラムとも開発が着実に進展するに伴い、「SB623」市販後のグローバル展開も含めた製造・物流・販売体制構築、日本における慢性期脳梗塞プログラムの単独開発、両プログラムの欧州等への拡大展開、事業領域拡大のための両疾患以外の各疾患(加齢黄斑変性、脊髄損傷、パーキンソン病、アルツハイマー病等)の研究開発など、今後の更なる成長に向けた資金調達の必要が生じている。そこで、新株予約権発行により約150億円の資金を調達することとした。
  ④ゲイリー・スタインバーグ博士がスミソニアン協会からアワードを受賞
サンバイオグループが米国で実施した慢性期脳梗塞を対象とした「SB623」のフェーズ1/2a臨床試験においてチーフ・インベスティゲーターを務めたスタンフォード大学医学部神経外科長ゲイリー・スタインバーグ博士が、米国スミソニアン協会からアメリカン・インジェニュイティ・アワードを授与された。この受賞は、同博士の脳梗塞患者の運動機能の改善をターゲットとした新しい治療におけるこれまでの研究活動を称えるもので、フェーズ1/2a臨床試験では「SB623」の投与により患者の運動機能が大きく回復するデータが示されている。 サンバイオグループのチーフ・メディカル・オフィサー兼リサーチ・ヘッドのダミエン・ベイツ医師は、「今回のスタインバーグ博士の受賞は、博士の長年の功績に十分値するものであり、脳梗塞の後遺症の治療薬として「SB623」を初めとする細胞を使った幹細胞治療の可能性に光を当ててくれるものです。」とコメントしている。 ⑤パイプライン拡大に向け新たな共同研究にも着手
国立大学法人京都大学と、同大学が研究を進めている新規神経新生促進化合物アルジャーノンに係る共同研究に関する契約を締結。更なるパイプライン拡大に着手した。(アルジャーノンとは?) 京都大学大学院医学研究科・形態形成機構学研究室萩原正敏教授の研究グループが、2017年にダウン症の出生前治療を可能にすると発表した新規化合物。 ダウン症では、神経幹細胞により供給される神経細胞数の低下が脳構造の発達不全の原因の一つであると考えられており、同研究グループはダウン症の疾患モデルを用いて、治療効果が期待される新規化合物「アルジャーノンを発見した。 アルジャーノンはダウン症で過剰発現していることが知られている遺伝子(DYRK1A)の機能を抑制し、神経幹細胞を正常に増やす作用があることがわかっている。神経幹細胞は発生期だけでなく成体にも存在することから、アルジャーノンは神経細胞の変性や損傷が原因で失われた運動機能、感覚機能、認知機能を再生させる効果が期待される。 (共同研究における取り組み) 今回の共同研究は、脳卒中に起因する神経系機能障害に対するアルジャーノンの効果を評価するもので、京都大学はプロジェクトの統括および脳卒中におけるアルジャーノンの薬理学的研究を、サンバイオは脳卒中モデル動物での薬効評価を担当する。 |
| 2019年1月期業績予想 |
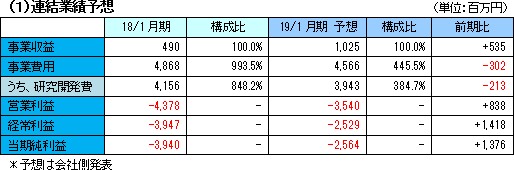 市販後の体制も見据えた投資を実施
事業収益は前期比5億35百万円増加の10億25百万円の見込み。大日本住友製薬からの開発協力金収入による。脳梗塞プログラムについては米国フェーズ2bおよび日本での開発準備費用を、外傷性脳損傷プログラムについては日米でのフェーズ2および市販後の体制構築に向けた費用など合わせ、45億66百万円の事業費用を見込み、営業損失は前期比8億38百万円縮小の35億40百万円と予想している。 経常損失は前期比14億18百万円縮小の25億29百万円の予想。カリフォルニア州再生医療機構からの補助金は、営業外収益として10億60百万円計上する計画。(同補助金は総額20百万米ドルのうち18百万米ドルを前期までに既に受領しているが、会計上は同機構からの承認時に計上するため受領時期と計上時期にズレが生じている。) |
| 森社長からのメッセージ |
|
さらに日本における外傷性脳損傷に関しては2020年1月期中の条件期限付き早期承認制度における申請を予定しており、販売開始も視野に入ってきた。 2016年に最初の被験者組入れを行った時点ではまだまだ「夢」のような存在であった両疾患に関する再生治療薬がいよいよ現実のものとなってきたわけで、国内外の多くの患者様の期待に応えられる日が近づいていると思うと、改めて身の引き締まる思いだ。 今回の新株予約権による資金調達の目的は大きく分けて3つある。 1つは、「SB623市販後の製造・物流・販売体制構築」。 当社がこれまでの「開発フェーズ」から「市販フェーズ」へ進むにあたっては、多くの患者様に安定的に高品質の治療薬をお届けするという責務を果たす必要がある。特に日本での販売に関しては、自社販売を中心に考えており、しっかりとした販売体制を構築しなければならない。 2つ目は、「日本での慢性期脳梗塞プログラムに係る開発及びSB623の将来の販売に向けた地域拡大のための研究開発」。 日本での開発は帝人との協議により当社単独で行うこととなったが、大きなご期待に沿うべくスピード感をもって開発を進め、早期承認制度を利用し、フェーズ2bが終了した米国よりも早い販売承認取得を目指す。また、日・米に次いで欧州での展開を自社単独、共同双方から検討していく。 3つ目は「SB623の新規適応拡大と新規物質の導入のための研究開発」。 現在まだ研究及び非臨床段階にある加齢黄斑変性、網膜色素編成、パーキンソン病、脊髄損傷といった疾患に関してもなるべく早く臨床試験フェーズに進めたい。また新化合物「アルジャーノン」を始めとした新規物質導入の研究にも注力し、更なるパイプラインの充実を図る考えだ。 昨年から今年にかけTV番組で「SB623」を取り上げていただく機会が増えたこともあって、より多くの患者様の声が届けられ、大きな励みとなっている。 また株価もこの1年で大きく居所を変えており、皆様の期待の大きさをひしひしと感じている。 そうしたご期待に応え、一日も早い販売スタートを目指し邁進していくので、是非引き続き中長期の視点での応援をお願いしたい。 |
|
| <参考:コーポレートガバナンスについて> |
 ◎コーポレートガバナンス報告書
最終更新日:2017年4月28日
◎コーポレートガバナンス・コードの各原則を実施しない理由
「当社はコーポレートガバナンス・コードの基本原則をすべて実施しておりますので、本欄に記載すべき事項はありません。」と記載している。
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2025 Investment Bridge Co.,Ltd. All Rights Reserved. |





