ブリッジレポート:(4597)ソレイジア・ファーマ vol.2
| (4597:東証マザーズ) ソレイジア・ファーマ |
|
||||||||
|
||||||||
企業名 |
ソレイジア・ファーマ株式会社 |
||
社長 |
荒井 好裕 |
||
所在地 |
東京都港区海岸1-2-20 汐留ビルディング |
||
決算期 |
12月末日 |
業種 |
医薬品(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2016年12月 | 501 | -462 | -494 | -474 |
| 2015年12月 | 229 | -702 | -710 | -643 |
| 2014年12月 | 11 | -702 | -701 | -677 |
| 株式情報(9/27現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
荒井社長率いる実務経験豊富な開発スタッフ、開発成功確率の高さ、安定した事業基盤、事業の早期実現可能性などが大きな強み・特長。 (※)スペシャリティ・ファーマ:得意分野において国際的にも一定の評価を得る研究開発力を有する新薬開発企業のこと。
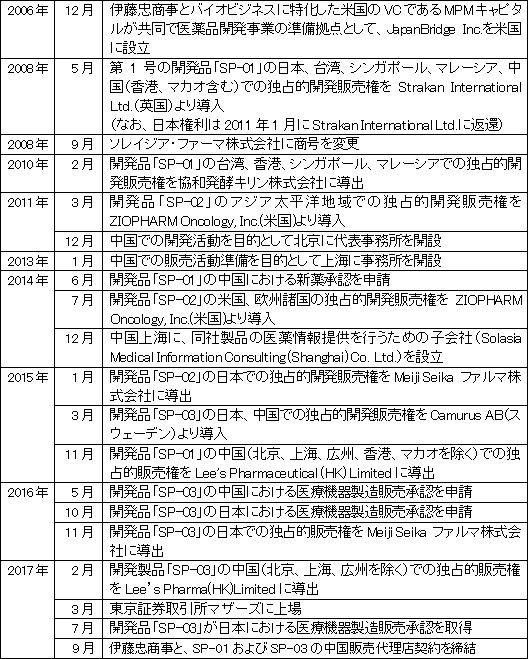
【1-1 沿革】
 【1-2 企業理念・経営理念】
社名のソレイジア(SOLASIA)は、Sol(ラテン語で太陽)+Asia(アジア地域)からなるもので、「日本・アジアにおいて、がんと向き合うさまざまな人たちの未来を照らす希望の太陽でありたい。」という想いを表している。以下のような、『経営理念:ミッション、ビジョン、バリュー』を掲げている。   また、現在は研究開発が先行しているため財務CFに頼らざるを得ない現状であるが、早期に営業CF黒字化を実現し、持続的成長が可能な基盤を構築する。 【1-3 同社を取り巻く環境】
厚生労働省「平成27年(2015)人口動態統計」によれば、2015年の死因別順位は悪性新生物(がん)が、死亡数370,346人で全死亡者数1,290,444人の28.7%を占め第1位であった。総人口の変化を加味した「死亡率(人口10万人に対し何人が死亡したか)」の推移を見ても、1981年に死亡率142.0人で、同134.3人の脳血管疾患に代わり第1位となって以来30年以上にわたり連続して第1位であり、その数値も年を追って上昇、2015年は295.5人となっている。 高齢化、また食生活を含めたライフスタイルの変化等によりがん発症率は上昇していると言われているが、中国においてもがんの発症者数及び死亡者数は増加傾向にある。 現在の国別医薬品市場規模は1位が米国で、中国が第2位だが、2020年には中国市場は米国市場と1位を分け合う規模まで拡大するとも言われている。 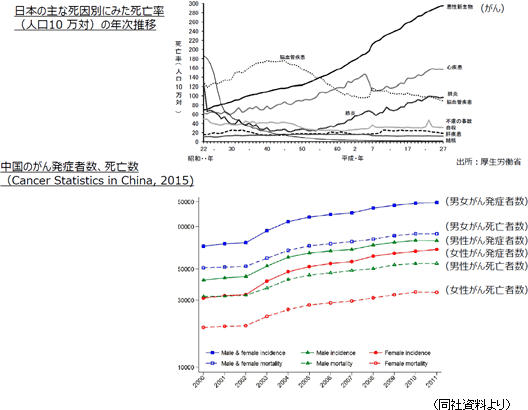 (新規抗がん剤) 抗がん剤を用いたがん治療においては、一つの抗がん剤のみを用いる単剤治療よりも、複数の抗がん剤を用いる併用療法のほうがより高い効果を期待できるといわれている。 加えて、がんは種類によって異なるが、再発の可能性が高く、加えて難治の場合は、一種類の治療での治癒は困難であるため、一つの治療薬が絶対的な存在とはならず、他の治療薬が直接的な「競合」とはなり難いという特性がある。 また、近年では、分子標的薬や免疫療法が注目されてはいるが有効性や普及という意味では、まだ緒に就いたばかりであり、伝統的な殺細胞性抗がん剤が標準治療として位置づけられている。 (がんサポーティブケア) 抗がん剤はがん細胞を攻撃する強力な医薬品であり副作用が避けられない。 患者に負担がかかる副作用をコントロールできなければ、抗がん剤投与によるがん治療そのものを中止せざるを得ず、結果的にはがんが進行してしまう。 こうした事態を避け、がん治療を完遂するためには、副作用のコントロールを行うための医薬品や医療機器への期待が高まっている。 また、がんの治療薬は、がんの種類ごとに承認を得なければならないが、サポーティブケアはがんの種類を問わず、幅広いがん患者への処方が可能であり、大きなニーズ、市場が見込まれる。 以上のように、日本・中国におけるがん治療ニーズの増大とそれに対応した新規抗がん剤およびがんサポーティブケアへの期待は大きく、同社はこうしたニーズを取り込み、収益を拡大させるためのビジネスモデル、事業戦略を構築している。 【1-4 事業内容】
(1)ビジネスモデル
新しい医薬品が上市されるまでには、「基礎研究」から始まり、「製剤研究」、「非臨床開発(動物を用いて薬効薬理作用、生体内での動態、有害な作用などを調べる試験)」、「臨床開発(医薬品や治療技術などの人間への影響を調べる科学的試験)」を経て、当局の承認を得たのち、「製造」、「販売・マーケティング・製造販売後調査」といったプロセスを経るのが一般的である。大手製薬会社は、巨額な研究開発費を変動費化することなどを目的にCROを利用した臨床開発段階のアウトソーシングを進めてはいるが、基本的には上記の工程全てを自社内に保有している。 これまではこうした体制が製薬会社の高収益体制を支えてきたが、近年の生命科学分野の急速な進歩や複雑化、多様化により、自社固有の創薬技術が陳腐化してしまう可能性が高まっている。 また、多額の費用と時間をかけて基礎研究から進めても臨床開発に入るまでに実用化を断念し、創薬技術を確立できないケースも多く、医薬品開発には常に高いリスクがついてまわる。 そこで同社では、失敗の確率の高い基礎研究から非臨床開発の工程を自社では行わず、まだ開発段階にある将来有望な医薬品を外部から導入して臨床開発から開発に着手。それ以降の事業活動に経営資源を集約することで自社の強みを発揮するとともにリスクの低減を図っている。 現時点ではコスト負担の大きい製造工程も保有しない計画である。  一般的に製薬企業の売上高総利益率は高水準であるが、これは、製造および販売活動を内製化することによって実現できると考えられる。  そこで同社では、臨床開発を終えた医薬品について、「自販モデル」と、販売権を他社に導出する「導出モデル」を併用している。 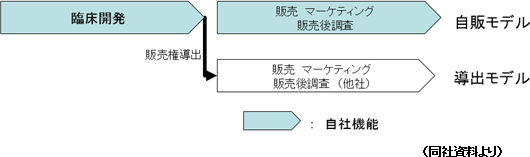 中国の3大都市「北京・上海・広州」においては自社販売体制を構築し自販モデルを展開する。 この3都市の人口合計は中国全人口の約5%に過ぎないが、抗がん剤を取り扱うのは最先端かつ大病院であるため、大病院が集中するこの3都市は中国の抗がん剤市場の3割を占める巨大マーケットである。 また、新しい医薬品の使用・普及にあたっては影響力のある医師の判断や決定がその結果を大きく左右する。こうした影響力のある医師の在籍する大病院への営業活動は極めて重要なポイントとなる。 加えて、中国全土ではなくあくまでもそれぞれの都市における営業であり、少人数の販売組織でも十分に活動は可能である。現在約50-60の大病院を対象とした営業スタッフ増強に動いている。 (導出モデル) 現在の主な導出先パートナーは以下の2社である。  (2)開発パイプライン
現在、前述の経営方針に沿って以下3つの開発パイプラインを有している。
 抗がん剤を投与すると、小腸にあるクロム親和性細胞と呼ばれる細胞がダメージを受ける。 ダメージを受けたクロム親和性細胞はセロトニンという神経伝達物質を放出。これが末梢の迷走神経上にある5-HT3受容体に取りこまれ、その刺激が末梢の迷走神経に沿って、脳の第4脳室最後野にある化学受容器引金帯(CTZ)を介して延髄に入り、悪心・嘔吐の命令を生体に出す嘔吐中枢を刺激し、悪心や嘔吐が発現する。 悪心・嘔吐を抑制するためにはセロトニンによる5-HT3受容体への刺激を遮断することが必要であり、そのために用いられる薬剤「5-HT3受容体拮抗薬」としては様々なものがあるが、代表的な薬剤がグラニセトロンである。 「SP-01」は、このグラニセトロンを含んだ5-HT3受容体拮抗薬の経皮吸収型製剤(貼付剤)で、貼り薬としては世界唯一。 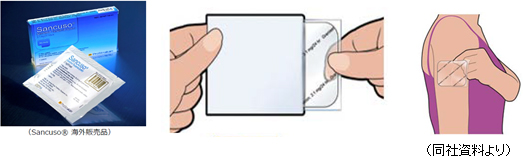 これに対し「SP-01」は5日間にわたって安定的に血中のグラニセトロン濃度を維持することができるため、1回貼り付ければ制吐剤を追加する必要がなく、入院ではなく外来によるがん治療を可能とするため、患者のQOL向上にも大きく貢献する。 悪心・嘔吐、口内炎などが原因で、薬剤の服用が困難な状態にある場合でも、経皮吸収型製剤は使用可能である点も大きなメリットであり、以上のような点を評価され、米国NCCN診療ガイドライン、中国治療ガイドラインで処方推奨を得ている。 現在上市または承認済の地域は、米国、英国、ドイツ、オランダ、デンマーク、スペインフィンランド、ノルウェー、スウェーデン、クウェート、レバノン、カタール、バーレーン、アラブ首長国連邦リビア、サウジアラビア、韓国、フィリピン、オーストラリア(以上、導入元が販売)、台湾、香港、シンガポール(以上、サブライセンス先の協和発酵キリンが販売)など多数にわたっている。 今後は、抗がん剤だけでなく放射線療法による悪心・嘔吐抑制への適応拡大を見込んでいる。  リンパ球には、B細胞、T細胞、NK細胞等の種類があり、これらががん化して無制限に増殖することで発症する。 末梢性T細胞リンパ腫(PTCL:Peripheral T-cell lymphoma)とは、悪性リンパ腫の種類の1つ。リンパ球の中のT細胞から発生するもので、月単位で病気が進行する「中悪性度」に分類され、中悪性度リンパ腫の10~15%を占めるといわれている。 B細胞リンパ腫などに比べ、5年生存率は低く、25%前後である。 「SP-02」は、この末梢性T細胞リンパ腫(PTCL)への適応で開発をスタートさせた。 2015年10月までに米国や日本、韓国等にて187名の被験者に投与される実績を有する。 米国における前期第Ⅱ相臨床試験は2012年4月に完了し、白人種における一定の有効性を確認した。 2015年4月に完了した日本および韓国における第Ⅰ相臨床試験では、競合品と比較して高い安全性が確認され、アジア人種における一定の有効性が示唆された。 悪性リンパ腫はしばしば再発することが知られており、作用機序の異なる複数の治療薬が必要でマーケットは大きいと同社は考えている。 末梢性T細胞リンパ腫のみでなく、その他血液がん(リンパ腫、白血病)や固形がんへの適応拡大を目指しており、2018年以降の開発開始を予定している。 日本での開発販売権はMeiji Seika ファルマ株式会社に導出済で、欧米及び中国では導出先を選定中である。  口内炎は、「化学療法が口腔粘膜へ直接作用して障害が生じるもの」や「放射線照射により唾液腺組織に障害が生じ、唾液の分泌低下により口腔内の自浄作用が低下し局所感染が起こることで発生するもの」である一次口内炎と、「白血球減少などに伴う骨髄抑制により起こる口腔内感染が原因となるもの」である二次口内炎がある。 抗がん剤治療に伴う口内炎の発生頻度は30~40%、抗がん剤と頭頸部への放射線治療併用時の口内炎発生頻度は約100%となっている。 癌化学療法又は放射線療法による口内炎は、300~500もの多数の炎症が発生する。その疼痛により患者は食事や水分の経口摂取が困難になり体力低下を招き、重症化すると本来のがん治療の継続にも悪影響を及ぼしてしまう。 ただ、現在のところ標準的な対処法はなく、各病院ごとでの対症療法に頼っているのが現状である。 「SP-03」は、脂質ベースの液体を口腔粘膜に吹きかけるものであり、同社ではカテゴリーとしては医療機器として開発を進めてきた。  2016年に日本における承認申請を完了していたが、2017年7月6日付けで、厚生労働省より、日本国内における医療機器製造販売承認を取得した。今後、保険収載を経て、日本における独占販売権の導出先であるMeiji Seika ファルマ株式会社より販売が開始される予定だ。 なお、中国においても2016年5月に医療機器製造販売承認申請を当局に行っており現在承認審査中だ。 日本以外では、米国、英国、ドイツ、デンマーク、ノルウェー、スウェーデンなどで他社及び導入元により販売されている。 以上3つのパイプラインの開発・事業化の経緯、現状、今後の計画は以下のとおりである。  【1-5 バイオベンチャーとしての6つの特徴】
バイオベンチャーとしての同社を特徴づけるのは主に以下の6点である。
① 創業の経緯
同社のスタートは、伊藤忠商事と米国のバイオに特化したVCであるMPMキャピタルによって設立された「JapanBridge(Ireland)Limited」。数社のバイオベンチャーから新薬の権利を導入し、開発を進めた。当初はExitとして製薬会社への売却を中心に考えていたが、4-5年ほど前からは事業の将来性、有望性から企業として永続的に事業を展開する方向にシフトし、研究開発に向けた資金調達も必要なため株式公開の道を選択した。 もともと他社への売却を念頭に置いていたことから、保有する開発品は開発段階ではあっても他社に売却して現金化可能な優良な資産で構成されており、創業時より既に強固な事業基盤を構築している。 ② 実務経験豊富な臨床開発陣
研究部門や前臨床部門を持たず、新薬開発の権利導入を活用し、臨床開発以降の医薬品創造プロセスに特化している。医薬品事業化への研究開発過程において最も大切なのは最終的に当局の承認を取得することであるが、そのためには臨床開発、特に第Ⅱ相以降の後期臨床段階におけるスキルやノウハウが最も重要である。 数多い日本のバイオベンチャーの中でも、社長が臨床開発をコアスキルとして身に付け、強力な武器としているのは同社荒井社長以外には見当たらない。 荒井社長率いる実務経験豊富な臨床開発スタッフは同社の強力な差別化要因、競争優位性である。 ③ 開発成功確率の高さ
創業以来、「SP-01」、「SP-02」、「SP-03」という3つの開発品を導入しているが、開発中止や失敗実績がなく、全開発品が事業化に至る最終段階(1つは日本で承認取得、1つは承認申請済、1つは最終臨床試験実施中)にある。この高い開発成功確率を可能にしているのは2つの要因である。 1つ目は、失敗のリスクの低いもののみを導入するビジネスモデル。 2つ目は、臨床開発のすべてを担うことのできるチームが社内にあること。前述のように、承認を取るためには何が必要かを熟知した開発陣は、導入品が承認をとれるか否かについてのスクリーニングをかけることができる。 1つ目、2つ目を合わせた、いわば「目利き力」が、開発断念に至るリスクを引き下げ、3打数3安打という高打率の源泉となっている。 ④ 安定した事業基盤
前述のように開発品3つ全てにおいて、製薬企業への販売権導出を達成しており、自社販売と組み合わせたリスクヘッジのためのポートフォリオを構築済である。
⑤ 高利益確保のための自販体制
製薬会社が高い収益性を実現できているのは、自社で製造・販売双方を手掛けているためだ。同社は現在のところ製造設備は保有していないが、収益性を高めるためにマーケットが大きくかつ効率的に営業活動が展開できる中国の三大都市(北京、上海、広州)に自社販売体制を構築中である。 ⑥ 事業の早期実現
バイオベンチャーの場合、新薬開発段階では損失を計上しているのが一般的であるため、株価や事業価値の算定において損益計算書を使用することは合理的ではなく、DCF(ディスカウント・キャッシュフロー)モデルを使用することとなるが、バイオベンチャーを対象とする場合、通常のDCFで使用される「時間」を基にした割引率以外に、新薬の臨床段階ごとの成功確率が割引率として考慮される。この場合、承認をいつ得ることができるかが最大のポイントとなるが、3つの開発品のうち、「SP-03」は既に承認を獲得し、「SP-01」は今2017年12月期の承認を予定している同社の新薬開発に関する割引率は、他のバイオベンチャーよりも低く想定されてしかるべきであろう。以上6点以外に中国市場での成長ポテンシャルの高さを挙げることができる。 世界のメガファーマも当然中国をはじめとしたアジア各国に拠点を設けているが、同社が開発の対象とするのは経営方針にあるように、大手製薬企業が業績重視の観点から着手しないがん領域や希少疾病領域での新規製品である。近年医薬品市場で注目を浴びるこうした製品はバイオベンチャー発のものであるが、大手は取り扱わないため、同社は、北京・上海・広州の自社販売網を含め、世界中のバイオベンチャーにとって急成長するアジア市場へのアクセスを提供できる貴重な存在となろう。加えて、中国ビジネスに強みを持ち筆頭株主である伊藤忠商事と香港、マカオを除く中国全土における販売代理店契約を締結し、そのネットワークを活用できる点も同社の大きなアドバンテージである。 |
| 2017年12月期第2四半期決算概要 |
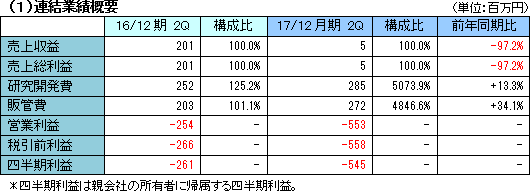 先行投資が継続中で損失拡大
売上収益は開発品SP-01の製品販売収入による5,632千円。売上総利益も同額で、SP-02の開発マイルストン収入200百万円があった前年同期に比べ大幅な減少となった。営業利益は553百万円の損失。臨床試験の推進を中心とする医薬品開発パイプラインの強化と事業化に注力し、研究開発を進めたほか、開発及び株式公開のための体制整備のコストが増加し、損失幅が拡大した。 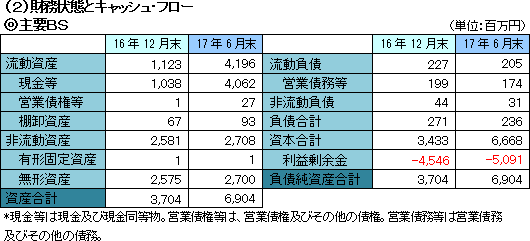 自己資本比率(親会社所有者帰属持分比率)は96.6%。 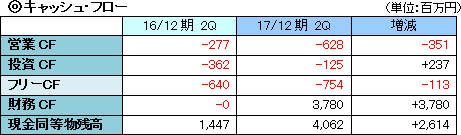 キャッシュポジションは前年同期に比べ26億円上昇した。 (3)トピックス
2017年9月13日、同社製品の中国国内での安定的な販売・流通を図ることを目的として、中国国内事業に大きなプレゼンスを有し、同社大株主でもある伊藤忠商事株式会社と販売代理店契約を締結した。◎中国における同社製品の販売代理店契約を伊藤忠商事と締結 対象地域は香港、マカオを除く中国全土。 対象製品は、「SP-01」および「SP-03」。 「SP-01」(2014年6月 開発完了)、「SP-03」(2016年5月 開発完了)ともに中国当局に承認申請済で、現在承認審査中である。 同社が自社販売体制を構築し自販モデルを展開する予定の中国の3大都市「北京・上海・広東省」においては、「同社→伊藤忠商事グループ→2次卸等→病院等」という経路で販売する。病院等への販売活動は、子会社のSolasia Medical Information Consulting(Shanghai)Co.Ltd.が行う。 上記3都市以外では「同社→伊藤忠商事グループ→Lee’s Pharmaceutical(HK)Limited(同社大株主)→2次卸等→病院等」へという経路となる。 ◎ベンチャーキャピタルの株式保有割合が大幅に低下
2017年8月22日、創業時より同社株式を保有していた米国のVC「MPMキャピタル(JapanBridge(Ireland)Ltd.)」の株式保有割合が2017年3月末の25.1%から、同年6月末に0%となったこと、ベンチャーキャピタル合計の保有割合も、同期間で36.0%から7.6%に低下したことが発表された。同社は有価証券報告書の「事業等のリスク」の一つとして「ベンチャーキャピタルによる株式保有に関する事項」を記載し、VC保有株式の売却に伴う市場価格に対する影響などを挙げていたが、今回の保有割合低下に伴い、今後は同リスクを記載しない見込みとなった。 |
| 2017年12月期業績予想 |
 業績予想に変更無し。減収、販売体制整備のための投資等で損失拡大
売上収益は前期比15.6%減少の4億23百万円の予想。下期に「SP-01」の中国当局承認に伴う導出先Lee's Pharmaceuticalからのマイルストン収入23百万円を計画。 「SP-03」の日本承認に伴うMeiji Seika ファルマからのマイルストン400百万円は2017年7月の当局承認を契機に既に収入している。 営業利益は17億87百万円の損失の予想。 臨床開発の最終フェーズに入っている「SP-02」の臨床試験費用を中心とした研究開発費は前期比70.8%増の8億12百万円を計画。 販管費は同186.3%増の13億98百万円を見込む。前期までは開発部門や管理部門の人件費や賃借費等の固定費が中心だったが、「SP-01」、「SP-03」については来期以降の販売開始を計画しているため、中国市場でのマーケティング費用、日本及び中国の管理ならびに開発体制の強化、中国子会社におけるセールスマーケティング強化のための人員増加など、その準備等に伴う費用が増加する。 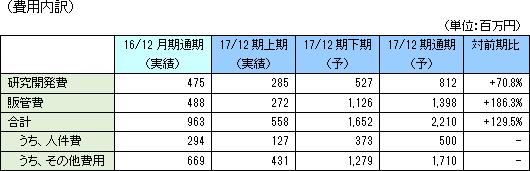 |
|
| <参考:コーポレートガバナンスについて> |
 ◎コーポレートガバナンス報告書
最終更新日:2017年3月24日<実施しない主な原則とその理由> 「当社は、コーポレートガバナンス・コードの基本原則をすべて実施しています。」と記載している。 |
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2025 Investment Bridge Co.,Ltd. All Rights Reserved. |





