ブリッジレポート:(4592)サンバイオ vol.3
| (4592:東証マザーズ) サンバイオ |
|
||||||||
|
||||||||
企業名 |
サンバイオ株式会社 |
||
社長 |
森 敬太 |
||
所在地 |
東京都中央区明石町8-1 聖路加タワー28F |
||
決算期 |
1月末日 |
業種 |
医薬品(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2016年1月 | 1,174 | -1,125 | -1,172 | -988 |
| 2015年1月 | 3,229 | 2,248 | 2,228 | 1,736 |
| 2014年1月 | 204 | -584 | -587 | -589 |
| 株式情報(7/12現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
【沿革】
麒麟麦酒株式会社(現 キリンホールディングス)で研究開発を行っていた森 敬太氏(サンバイオ株式会社 代表取締役社長)は、自ら新しい事業に挑戦したいと考えていたところ、旧知の友人で、大手コンサルティング会社ボストンコンサルティング・グループのコンサルタントを経て、製薬企業向け営業支援を行う(株)ケアネット(2150、東証マザーズ)の創業に携り同社副社長であった川西 徹氏(サンバイオ株式会社 代表取締役会長)と、起業に関して意気投合した。将来の方向性など様々な議論を行うなか、2人とも大学時代に農学部でバイオテクノロジーを専攻していたこともあり、「バイオの世界で、新しい分野、新しい市場を創り出す」ことに目標を定めた。具体的な分野として将来性の大きい「再生細胞薬」に注目し、その製品化・事業化を目指して、2001年2月、SanBio, Inc.を米国カリフォルニア州に設立した。 創業にあたり、慶應義塾大学 岡野 栄之(ひでゆき)教授(脳神経領域の再生医療、iPS研究で世界の第一人者。現在、慶應義塾大学医学部長、日本再生医療学会理事ほか)の研究分野に着目し、協力を願い出たところ快諾を得て、同氏の紹介もあり、2002年12月、神奈川県内の国公私立大学の研究成果を企業に橋渡しする技術移転機関「よこはまティーエルオー株式会社」から、現在の開発品の基本技術となっている基本シーズに係る知的財産の譲渡を受けた。岡野氏は創業科学者としてサンバイオの創業以来、科学的な見地からのアドバイスを提供している。一方、米国では、再生医療分野での強力なネットワークを通じて、各分野の有力なアドバイザーや、優秀な研究員を獲得し、再生細胞薬の開発、製造及び大量生産技術の確立を進めてきた。 サンバイオは、同社の開発する再生細胞薬の開発・販売について、大手製薬会社との提携を模索していたが、2009年12月に再生細胞薬「SB623」の日本における慢性期脳梗塞用途の開発専用実施権許諾契約を帝人株式会社と締結し、翌2010年5月には脳梗塞について、米国食品医薬品局(Food and Drug Administration以下、FDA)から臨床試験開始の承認を取得した。一方、2010年9月には大日本住友製薬株式会社と米国及びカナダにおける慢性期脳梗塞用途のオプション契約を締結。 2011年1月には米国において「SB623」の脳梗塞分野における臨床試験(フェーズI/IIa)を開始し、2013年8月には被験者18名に「SB623」の投与を完了し、SB623の安全性と統計学的に有意な有効性データが確認された。 2012年12月に京都大学の山中伸弥教授がiPS細胞の開発でノーベル賞を受賞したことに加え、2014年11月に改正薬事法及び再生医療新法が施行され、再生医療等製品について早期承認制度がスタートしたのを契機に、再生医療分野での日本の存在価値が世界的に急速にクローズアップされるなか、これを絶好の機会と捉え、日本を経営の中心に米国を研究開発の拠点に世界的な事業展開を図るべく、2013年2月、日本にサンバイオ株式会社を設立。2014年1月には、サンバイオ(株)を親会社、米国のSanBio, Inc.を完全子会社とする企業再編を行い、2015年4月東証マザーズ市場に上場を果たし、日本におけるバイオベンチャーIPOとしては最大規模の73億円を調達した。 2014年6月、米国において「SB623」のフェーズI/IIa臨床試験の結果を受けて、FDAから次のフェーズIIbの臨床試験実施承認を取得したのを機に、同年9月には、大日本住友製薬株式会社が先に締結したオプション契約を行使し、米国及びカナダにおける「SB623」の慢性期脳梗塞用途の共同開発をスタートしている。 一方、米国での外傷性脳損傷疾患を対象としたフェーズI臨床試験については、2013年5月にFDAから試験開始の承認を取得し、治験の準備を進めていたが、その後、2015年4月には、先に実施された脳梗塞を対象とした臨床試験の結果を受けフェーズIをスキップしフェーズIIからの臨床試験開始の承認を取得。2015年10月に外傷性脳損傷のフェーズII(被験者52名、二重盲検試験)の被験者募集が開始されている。本試験は、2016年4月に日本においても独立行政法人医薬品医療機器総合機構(PMDA)から臨床試験実施の許可がおりたことから、現在、日米合わせて52人の被験者を対象としたグローバル治験となっている。 また、北米における慢性期脳梗塞のフェーズIIb(被験者156名、二重盲検試験)の臨床試験が、2015年12月に被験者募集を開始、2016年3月に最初の被験者の組み入れを実施するなど、開発は着々と進展している。 【サンバイオグループと開発体制】
沿革で触れたように、同社グループは、サンバイオ株式会社とその連結子会社SanBio. Inc.(米国カリフォルニア州)の2社から構成されている。再生細胞薬の研究開発については、2001年の創業以来一貫して、米国SanBio, Inc.の世界最高の開発・製造チームが中心になって手掛けているが、世界を見据えた事業展開を視野に、現在日本においても開発体制の拡充を進めている。 【企業理念】
慢性期(※1)脳梗塞、外傷性脳損傷、加齢黄斑変性、網膜色素変性、パーキンソン病、脊髄損傷、アルツハイマー病等のアンメットメディカルニーズ(※2)のある疾患を対象に再生細胞薬による治療法を確立することで、世界中のこれら疾患を抱えた患者の治療・身体機能の改善に寄与することをグループのミッションとしている。
※1 慢性期:同社では、脳梗塞や外傷性脳損傷において、発症もしくは受傷後6カ月あるいは6か月以上が経過したものを慢性期と定義している。
※2 アンメットメディカルニーズ:未だ有効な治療法がない治療ニーズ。  【同社を理解する上でのポイント】
同社の事業内容を理解するには、細胞、脳の再生、再生医療など知っておくべきポイントがいくつかある。
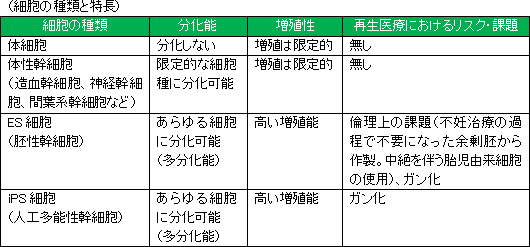
<細胞>
<脳の再生>
<ES細胞・iPS細胞 対 間葉系幹細胞(MSC)>
 <再生医療>
再生医療とは、損傷を受けた生体の機能を、細胞や、細胞外マトリクスや成長因子などを用いて復元または活性化させる医療。具体的には、患者に患者本人若しくはドナーの幹細胞を移植し、目的の細胞に分化したり、既存の細胞に作用したりすることで疾患を治療するもので、従来はなし得なかった根本的な治療を可能にすると言われている。
①再生医療とは ②世界が注目する日本の事業環境
経済産業省の資料によると、2012年に国内90億円、海外1,000億円だったと推計される再生医療市場は、2050年にそれぞれ2.5兆円、38兆円規模に拡大する見込み。2006年、2007年に山中教授がiPS細胞に関する画期的な成果を上げる一方で、米国では2009年3月にオバマ大統領が、ブッシュ政権が禁じていたES細胞への連邦政府助成を解禁する法案に署名するなど再生医療における研究競争が激化する中、日本では「激化する研究競争を勝ち抜き、患者のための臨床技術とするためには、産学官が一体となった強力な体制が必要不可欠」(「再生・細胞医療の現状及び課題 2012年9月26日 厚生労働省 医政局研究開発振興課」より)との認識が強まり、「再生医療」は日本再興戦略の重要テーマの一つとして掲げられることとなった。 そうした動きに応じて、2014年11月25日には医薬品医療機器等法(薬事法が改正・名称変更された。以下、改正薬事法とも使用)や再生医療等安全性確保法が施行され、再生医療の承認に向けた法体系が確立された。特に、改正薬事法に導入された早期承認制度においては、これまで5~8年かかった臨床試験から承認までの期間が3年半と短くなった。また、再生医療等安全性確保法においては細胞培養加工の外部委託が認められたことも極めて画期的で、多くの海外企業がアライアンス等を通じて日本での事業開始を表明するなど、日本の再生医療を取り巻く環境は世界が注目するところとなっている。 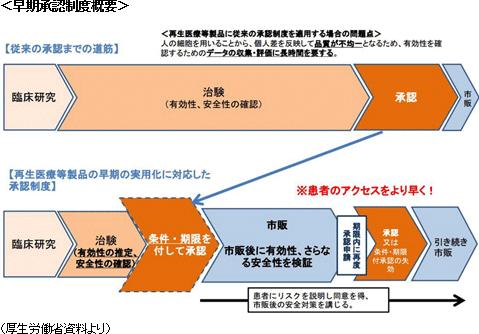 【事業内容とビジネスモデル】
主に脳神経に係る疾患である、慢性期脳梗塞、外傷性脳損傷、加齢黄斑変性、網膜色素変性、パーキンソン病、脊髄損傷、アルツハイマー病等のアンメットメディカルニーズのある疾患を対象とした再生細胞薬の開発、製造、販売を手掛けている。
<再生細胞薬>
同社グループは上記疾患を対象とした再生医療において、「再生細胞薬」の投与による治療を目指している。①再生細胞薬とは サンバイオの再生細胞薬は、患者自身の細胞の再生機能を高め、病気・事故等で失われた身体機能の自然な再生プロセスを誘引ないし促進させ、運動機能、感覚機能、認知機能を回復させる効能が期待される医薬品である。 ②他家移植 対 自家移植
再生医療に使用される細胞としては、「自家(じか)移植」と「他家(たか)移植」の2種類がある。「自家移植」は患者本人から細胞を採取して加工・培養し、元の患者に移植し、治療するもの。これには、移植細胞の生着と栄養分を送るための血液供給機構が必要となる。さらに必要に応じて調製、加工、培養される。 「自家移植」による再生医療としては、前述のテルモの骨格筋芽細胞シートがこれにあたる。 患者の大腿部より筋肉組織を採取。組織内に含まれる骨格筋芽細胞を培養してシート状にし、そのシートを元の患者の心臓表面に移植することにより、重症心不全の病態改善が期待できるというもので、培養する細胞は患者自身から採取する自家細胞のため、理論的には免疫拒絶反応がないことが特徴として挙げられる。しかしながら、自家培養であっても、培養に使用される材料によっては免疫反応が起こる場合もあるという。自家移植は一般的に、「細胞調製に時間と手間がかかる」、「個人間のばらつきが大きい」などの点が指摘される。 他方、「他家移植」の場合は、健康なドナーから採取した細胞を加工・培養して量産化する。一人のドナーから数千人分の治療薬を製造することが可能であるため、自家移植に比べて、より低コストで治療できる。「他家移植」は、安全性および免疫適合性の問題をクリアできれば、多くの疾患に対する再生医療としてより良い選択肢となる。 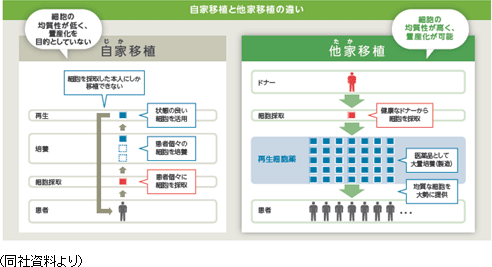 同社グループのミッション『再生細胞薬を用いて世界中のアンメットメディカルニーズの疾患を抱えた患者の治療・身体機能の改善に寄与する。』を実現するためには、「医薬品」として大量に生産し、既存の物流に乗せて世界中に届けることができる「他家移植」を採用している。 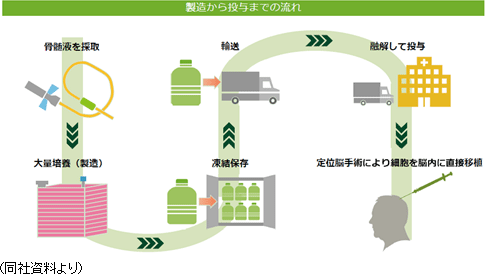 ③量産化について
再生細胞薬の実用化にあたっては、量産化技術の確立がカギを握るが、サンバイオはすでにその点をクリアしている。
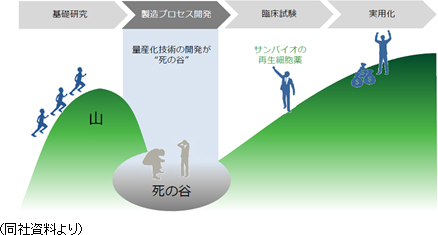 しかしながら、再生医療関連企業で量産化まで技術を確立できている企業は非常に少ない。従来の薬に比べて構造が複雑なものを取り扱う再生医療ビジネスにおいては、実用化に至るまでに「量産化」という超え難い「死の谷」が存在する。同社は、その「死の谷」をすでに超えているという点で、他社を大きくリードしていると言えよう。 ④再生細胞薬「SB623」
現在は、「SB623」の慢性期脳梗塞および外傷性脳損傷を対象とした開発が最も進んでいる。当面は、「SB623」の適応疾患拡大に注力する模様だが、将来的には、「SB623」のほか、「SB618」や「SB308」といった異なる機能を持った細胞薬の開発も進めていく。
  (1)「SB623」の効能
「SB623」は神経機能を再生する作用を持つ可能性を持つ治療薬で、体の自然な再生プロセスを促進させ、病気やケガで失われた運動機能、感覚機能及び認知機能の再生を目標としている。具体的な発現作用としては、①神経細胞をまもる、②神経細胞をつくる、③血管をつくる、④炎症を抑える等があり、これまでの研究によると、これらが複合的に作用することが示唆されている。「SB623」の現在の中心的な対象疾患である脳梗塞は、脳の血管が詰まることで、その先の神経組織に栄養が届かなくなり、細胞が機能を失ったり死んでしまう病気である。脳梗塞は、発作後数時間までの急性期には血栓溶解剤も有効だが、それを過ぎるとリハビリ以外に対処方法はなく、さらに6~12カ月を過ぎた慢性期に入ると多くの場合、リハビリによる改善効果も期待できないと言われる。 同社グループでは、米国で2011年から慢性期の脳梗塞患者に対して、2年間の「SB623」の安全性と有効性を確認するためのフェーズI/IIa臨床試験(フェーズIとフェーズIIの一部を同時に行い、再生細胞薬の安全性と有効性を同時に確認したため、フェーズI/IIaとしている。)を実施し、2014年2月に最後の投与患者の投与後6カ月の効果測定が完了した。この結果、副作用は認められないこと(安全性)、脳梗塞患者の運動機能が改善したこと(有効性)が確認され、同年6月には次の臨床試験のステップ(フェーズIIb)に進むことについての承認をFDAより得た。 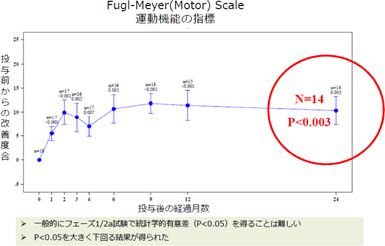  https://www.youtube.com/watch?v=E4WXwhTp7Ow&end=215 (2)「SB623」の投与方法
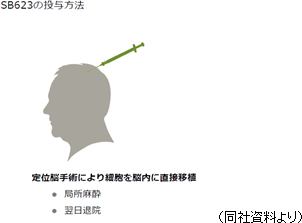
投与方法は、慢性期脳梗塞の場合、定位脳手術と呼ばれる既に脳神経外科では広く普及した手技により、局所麻酔で安全に投与される。
 (3)開発の進捗
米国においてはフェーズI/IIaの2年間の経過観察期間が2015年8月に終了し、2015年12月に、フェーズIIb(患者数156名)の被験者募集を開始し、2016年3月8日には被験者への投与を2例実施した。これにより共同開発パートナーである大日本住友製薬から500万ドルのマイルストンを受領した。◎慢性期脳梗塞 今後は脳梗塞発症後6か月から5年が経過した運動機能障害がある慢性期の患者を対象に全米60施設で156症例を目標に投与を行う。 日本においてはライセンスアウト先の帝人が開発を担っている。 ◎外傷性脳損傷
慢性期脳梗塞に次ぐ「SB623」の疾患ターゲットとしては外傷性脳損傷用途の開発も進んでいる。外傷性脳損傷は、交通事故や転倒などで頭に強い衝撃が加わり脳が傷つくことによって起こる疾患で、半身の麻痺や感覚障害、記憶障害等の他、行動や感情のコントロールが困難になる高次脳機能障害といった深刻な後遺症が残る。改善を期待できる期間は脳梗塞よりもやや長いものの損傷後半年から1年程度にとどまり、それを超えると有効な治療法が存在しないとされている。なお、米国で救急受診する患者数は年間約250万人で、後遺障害を抱える人の数は米国だけでも530万人に上ると推計されている。 外傷性脳損傷は、損傷部位や症状が脳梗塞に似ているほか、SB623の投与方法も同様であることから、SB623の適応疾患として可能性が期待されるが、そういったこともあり、フェーズIをスキップし、フェーズIIから治験を開始することでFDAと合意し、その後、2015年10月に被験者募集を開始している。 日本においては、2016年3月7日付で外傷性脳損傷を対象とした治験届を独立行政法人医薬品医療機器総合機構(PMDA)に提出し、日本における審査期間の30日が経過したことにより、日本での臨床試験の実施が可能となった。 2016年7月、フェーズII臨床試験において米国で最初の被験者の組み入れを実施したが、日本での臨床試験については、この臨床試験フェーズIIをグローバル治験として実施し、今後日本からの被験者を組み入れる。 2017年1月期中に、日米あわせて約25施設において、被験者合計52人を対象に被験者の組み入れを急ぐ。 改正薬事法における早期承認制度を最大限活用することで、SB623の日本での早期販売を目指す考えだ。 <同社スタッフの声> チーフ・メディカル・オフィサーおよび研究部門の責任者 ダミアン・ベイツ氏 「サンバイオの再生細胞薬SB623については、慢性期脳梗塞の患者様に対して運動機能の改善効果が確認されており、非臨床データでは外傷性脳損傷への応用の可能性も示唆されています。現在当社では、世界で初めてとなる他家由来の再生細胞薬を使った外傷性脳損傷を対象とするグローバル治験フェーズ2が、日本での治験許可がおりたことにより、日米双方で進められることになりました。今後、他の疾患への適応拡大も積極的に検討してまいります。」 日本の臨床開発部長兼メディカル・ディレクターである金子健彦氏 「日本においても、SB623が臨床開発の段階へと前進することができたことを大変嬉しく思っております。運動障害に苦しんでおられる患者様のために、一刻も早く貢献できるよう、SB623の臨床開発を進めてまいります。」 ◎加齢黄斑変性
「SB623」は強い神経保護作用を持つと考えられることから、網膜疾患への適応可能性が期待されている。黄斑(おうはん)とは網膜の中央にあり、ものを見るために一番重要な部分。ものの形、大きさ、色、立体性、距離などの光の情報の大半を識別している。加齢とともに徐々に網膜の細胞が死滅する結果、視力が低下したり、ものの見え方に支障が出るのが加齢黄斑変性症である。そのなかでも患者数の多いドライ型については、根本的な治療法が存在しない。 患者数が多く、新たな治療法の確立が待たれている同疾患に対して、同社は、特に加齢黄斑変性(ドライ型)および網膜色素変性を次の疾患ターゲットに開発を進めている。 同社では、網膜変性の動物試験(非臨床試験)の結果をもとに、2014年1月に、FDAとINDミーティング(新薬の臨床試験申請前の情報提供)に向けた事前ミーティングを実施した。現在は今後米国で臨床試験を実施するために必要な非臨床試験の追加データについて準備を進めている。 <ビジネスモデル>
大学等の研究機関から技術を取得して同社が製造開発、非臨床試験、臨床試験を実施し、医薬品の販売網を有するパートナー製薬会社に開発権及び販売権をライセンス許諾する。契約に応じて、①契約一時金、②マイルストン収入、③開発協力金、④ロイヤルティ収入、⑤製品供給に係る収入等を得るビジネスモデルとなっている。①概要 技術導入、研究開発・試験、製品製造については、委託先である大学等研究機関、研究受託機関、製造受託機関等に対し適宜委託費用を支払う。なお、ライセンス許諾のタイミングは、安全性と有効性を確認する段階まで開発を進めた時点など、製品価値の最大化を目指して決定している。 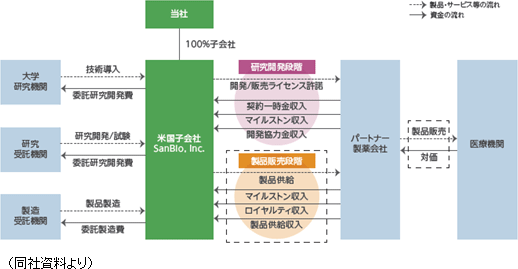  収入は、開発段階においては、①契約一時金、②開発マイルストン収入、③開発協力金のいずれか、又はすべてで構成され、製品上市後は、売上マイルストンに関する②販売マイルストン収入、④ロイヤルティ収入、⑤製品供給収入が主な収入形態となる。④ロイヤルティ収入、⑤製品供給収入は製品売上の一定割合として支払われるため製品売上に比例して増加することとなる。 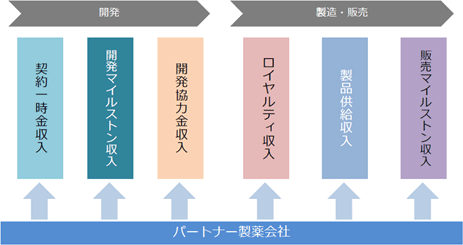 ②パートナー製薬会社との提携状況
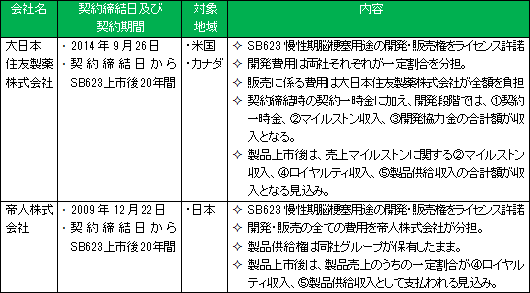
現在、「SB623」の慢性期脳梗塞用途の開発、製造、販売については、パートナー製薬会社として、北米においては大日本住友製薬株式会社と、日本においては帝人株式会社と、それぞれ契約を締結している。
  【特徴と強み】
同社の再生細胞薬の対象となる疾患は、世界的に旧来の医療では対応できなかった中枢神経系領域が中心であるため、対象患者数が多いことが見込まれる。①巨大なターゲットマーケット 脳卒中患者数は米国においては約660万人と言われている。日本では、厚生労働省「2014年 患者調査」(2015年12月発表)によれば、2014年の脳血管疾患(脳卒中)総患者数は推計で117万9千人。前回調査(2011年)の123万5千人から若干減少してはいるがおおよそ国民の100人に1人という割合となっている。 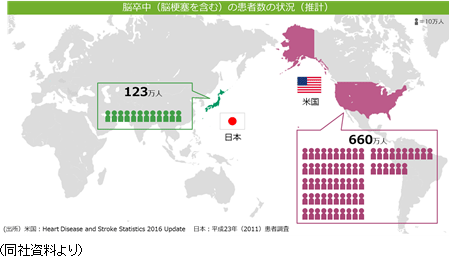 後者2疾患の総患者数は脳卒中よりも少ないが、特にアルツハイマー病の患者数は近年急速に増加しており、有効な治療法に対するニーズは高まっている。 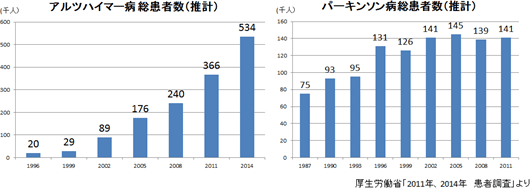 ②競争優位性を高める特許戦略
開発及び製品販売に伴う収入の極大化を目指すため、再生細胞薬の開発に必要な知的財産を全て自社で取得することを特許戦略の基本方針としており、開発を進めている再生細胞薬(SB623、SB618、SB308)の基本特許は全て取得済みだ。現在、以下の様に主要市場全てで基本特許を取得済みであり、今後は米国・カナダにおける大日本住友製薬、日本における帝人の様な有力なパートナー製薬企業との契約締結を進め、世界各地における臨床試験、製造開発、製品販売に向けた基盤の整備を進めていく考えだ。 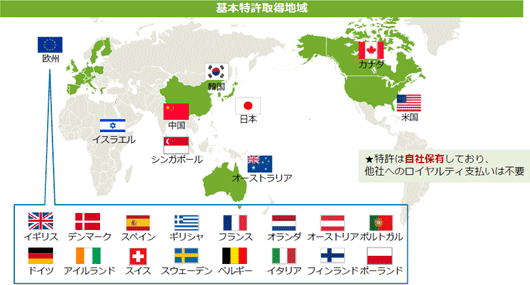 このうち物質特許は物質そのものを保護する特許で、医薬品の特許のなかで最も重要で権利範囲の広い特許として取得に大きな費用と時間が必要になる。物質特許を取得できれば、開発した医薬品を独占的に製造・販売することができるため、同社グループでは「物質特許」の取得に最も力を注いでいる。 ③製品供給権を確保
他社からライセンス導入して研究開発を行う創薬ベンチャー企業の場合、多くはパートナー製薬会社が製造を担い創薬ベンチャー自らが製品供給権を保有していないため、製品販売後の売上は製品販売に伴うロイヤルティ収入のみとなってしまう。これに対し同社の場合、再生細胞薬は、他社からのライセンス導入品ではなく、基礎段階から自社で研究開発を行ってきた独自製品である。そのため、パートナー製薬会社との関係においては、再生細胞薬の製造を同社が担うため、製品販売後は製品販売に伴うロイヤルティ収入に加え、製品供給の対価として製品供給収入も獲得することが可能であり、収益源がより多角化している点も注目される。 ④確立された量産化技術&再生細胞薬の安全性
前述の様に、加工培養、製造、保存、輸送、投与までの技術は既に確立されており、製品販売後の量産に対応できる段階に達している点も大きなアドバンテージとなっているほか、倫理上の問題を指摘されるES細胞や、がん化リスクのあるiPS細胞に比べ安全性が高いと考えられる点からも、臨床現場から受け入れられやすいと想定できることも同社の差異化要因である。
|
| 2017年1月期第1四半期決算概要 |
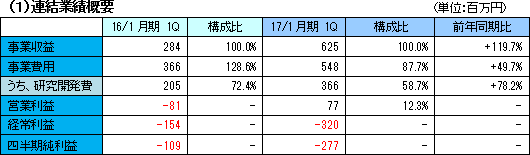 開発は着実に進展。研究開発を継続
売上高は、前年同期比119.7%増の6億25百万円。北米において大日本住友製薬株式会社と締結している「SB623」の共同開発及びライセンス契約によるマイルストン収入5百万米ドル(米国の慢性期脳梗塞の臨床開発フェーズIIbにおける最初の被験者の組み入れ完了により受領)及び開発協力金収入により大幅に増加した。引き続き慢性期脳梗塞の臨床開発フェーズIIbおよび外傷性脳損傷のフェーズ2開始、ならびに日本における外傷性脳損傷の治験準備開始に伴う研究開発費の増加などで事業費用は同49.7%増加の5億48百万円となったが、大幅増収で吸収し、営業利益は同78.2%増の77百万円となった。 円高により保有外貨資産において為替差損3億64百万円(前期は17百万円)を計上したため、経常利益は3億20百万円の損失となった。 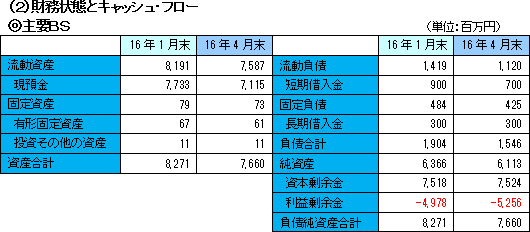 流動負債は、短期借入金の減少等で同2億99百万円減少し、負債合計は同3億58百万円減少の15億46百万円となった。 利益剰余金の減少により純資産は同2億53百万円減少の60億81百万円となった。 自己資本比率は前期末の77.0%から2.8ポイント上昇し、79.8%となった。 (3)トピックス
2016年6月2日、同社グループは、American Heart Association(米国心臓協会)が発刊している専門誌Strokeに、「脳梗塞患者を対象とした、一過性に遺伝子導入した骨髄由来間葉系幹細胞を用いたフェーズ1/2a 試験結果◎脳梗塞を対象とした米国での臨床試験フェーズI/IIaの試験結果を専門誌Strokeに論文発表。 (Clinical Outcomes of Transplanted Modified Bone Marrow-Derived Mesenchymal Stem Cells in Stroke: A Phase 1/2a Study)」が論文掲載されたと発表した。また、同社は、2016年6月22~25日にサンフランシスコで開催された国際幹細胞学会(ISSCR)において、同試験で得られた結果を発表した。 本試験は、北米において脳梗塞の治療として脳内へ細胞を移植した最初の臨床試験。 患者18例を対象とした非盲検単回投与試験(※)で、脳梗塞発作後6ヵ月以上が経過した運動障害を有する慢性期の患者を対象に実施した。 投与の結果、「SB623」を投与した患者16例について、多くの有効性評価項目(European Stroke Scale、National Institutes of Health Stroke Scale、Fugl-Meyer Total Score 及びFugl-Meyer Motor Function Total Score など)において統計学的に有意な運動機能の改善が示された。 同社グループのチーフ・メディカル・オフィサー兼リサーチヘッドのダミアン・ベイツ医師は、「これは、脳梗塞によって慢性的な運動障害を持つ患者様にとって有効な治療法を提供する大きな一歩になりました。」とコメントしている。 同試験において、「SB623」の安全性および忍容性(※)は良好であった。全ての患者で今回の治療に関連する軽度の有害事象が報告されたが、そのほとんどが頭痛であり、「SB623」が原因となる重篤な副作用の報告は無かった。 同社グループの臨床開発部長のジェリー・ルー医師は、「本試験の投与後12か月後の試験結果を受け、その素晴らしい結果に大変満足しています。」とコメントした。 同社では今回の試験について、投与後24か月まで経過観察を行い、その結果についても今後公表する予定だ。 前述の様に、同社グループは、北米地域における共同開発パートナーである大日本住友製薬株式会社とともに、2015年に慢性期脳梗塞を対象としたフェーズIIb試験を米国で開始した。また、外傷性脳損傷を起因とする慢性期の運動障害を対象としたフェーズII試験については、2015年に同社グループ単独で試験を開始している。 (※)忍容性
薬物の有害作用(副作用)が被験者にとってどれだけ耐えうるかの程度を示すもの。薬物の服用によって、有害作用(副作用)が発生しても被験者が十分耐えうる程度であれば、「忍容性が高い」、逆に耐えられない程の有害作用が発生する場合は「忍容性が低い」という。 ◎米国における外傷性脳損傷を対象としたフェーズII臨床試験の被験者組み入れを開始
2016年7月11日、日米で開発を進めている再生細胞薬「SB623」の外傷性脳損傷を対象としたフェーズII臨床試験について、米国ジョージア州アトランタにあるエモリー大学病院において最初の被験者の組み入れを実施した。今回実施するSTEMTRA(Stem cell therapy for traumatic brain injury:外傷性脳損傷に対する幹細胞療法)試験(※)では、外傷性脳損傷に起因する慢性期の運動障害をもつ患者を対象に、一過性に遺伝子導入した成人骨髄由来の間葉系幹細胞を加工・培養して製造した「SB623」を用いた同社グループ独自の再生細胞薬の治療効果を評価する。「SB623」は脳内の神経組織に投与されると、自然な再生機能を誘発することで失われた運動機能の改善を促す。 同社のチーフ・メディカル・オフィサー兼研究開発責任者のダミアン・ベイツ医師は以下のように述べている。 「SB623を用いた治療については、虚血性脳梗塞に起因して運動機能に障害が残った慢性期の患者様に対して、運動機能の改善効果をもたらすデータが示されています。外傷性脳損傷についても、非臨床試験で有効性を示唆するデータが出ており、今回の被験者への組み入れ開始は、外傷性脳損傷の後遺障害で苦しむ患者様に対して治療の新たな選択肢を提供するという目標にさらに一歩近づいたという点で非常に重要なマイルストンといえます。」 今回の試験は、米国で行われた虚血性脳梗塞を起因とした慢性期の運動障害をもつ患者を対象としたフェーズI/IIa試験において「SB623」の投与により統計学的に有意な運動機能の改善がみられた結果を受けて実施されるもの。 試験では、SB623細胞移植療法の有効性、安全性、忍容性について評価を行う。外傷性脳損傷受傷後12カ月以上が経過した患者様を対象としており、日米あわせて約25カ所の医療機関で実施されるグローバル治験で、被験者数は日米合計52名を予定している。 (※)STEMTRA試験について
外傷性脳損傷に起因する慢性期運動障害をもつ患者を対象として、一過性に遺伝子導入された成人ドナーの骨髄由来の間葉系幹細胞であるSB623細胞を用いた同社独自の再生細胞薬の治療効果を評価する試験。 |
| 2017年1月期業績予想 |
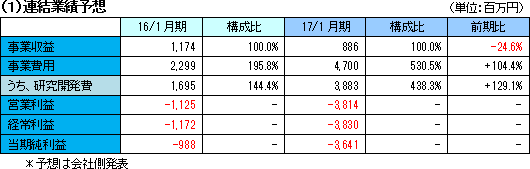 業績予想に変更無し。先行投資を継続し開発生産体制を拡充
業績予想に変更はない。売上高は前期比24.6%減の8億86百万円の予想。第2四半期予想および通期予想に対する第1四半期実績進捗率はそれぞれ85.0%、70.5%となっている。 事業費用は同104.4%増加の47億円の予想。米国における慢性期脳梗塞の臨床試験フェーズIIb及び外傷性脳損傷向けのフェーズIIが開始されたことに伴い臨床開発費用が前期に比べて大幅に増加するほか、日本においても外傷性脳損傷プログラムの治験開始を予定している。日米のこれらフェーズ2治験完了に必要な費用のほぼ全額を計上する。また、引き続き、臨床試験の進展および量産体制の拡充に必要な人員増強も図っていく。このため、研究開発費用は同129.1%増の38億83百万円を見込んでいる。この結果営業損失は前年同期より26億89百万円拡大し、38億14百万円の予想。 |
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2025 Investment Bridge Co.,Ltd. All Rights Reserved. |





