ブリッジレポート:(7776)セルシード vol.18
| (7776:JASDAQ) セルシード |
|
||||||||
|
||||||||
企業名 |
株式会社セルシード |
||
社長 |
橋本 せつ子 |
||
所在地 |
東京都新宿区原町3-61 桂ビル4F |
||
決算期 |
12月末日 |
業種 |
精密機器(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2013年12月 | 105 | -534 | -581 | -584 |
| 2012年12月 | 75 | -846 | -842 | -913 |
| 2011年12月 | 86 | -1,418 | -1,358 | -1,442 |
| 2010年12月 | 66 | -1,204 | -1,002 | -1,009 |
| 2009年12月 | 87 | -785 | -788 | -790 |
| 2008年12月 | 61 | -778 | -644 | -650 |
| 2007年12月 | 40 | -809 | -614 | -616 |
| 2006年12月 | 23 | -672 | -464 | -470 |
| 2005年12月 | 34 | -412 | -336 | -343 |
| 2004年12月 | 53 | -257 | -214 | -215 |
| 株式情報(3/12現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
事業は、細胞シート再生医療製品及びその応用製品の研究開発・製造・販売を通じて、細胞シート再生医療の普及を推進する「細胞シート再生医療事業」、細胞シートの基盤ツール(培養器材)である温度応答性細胞培養器材及びその周辺製品の研究開発・製造・販売を行う「再生医療支援事業」に分かれる。 【細胞シート工学と細胞シート再生医療】
「細胞シート工学」は再生医療の汎用的なプラットフォーム技術となるもの。患者から細胞を採取し、これをシート状に培養し治療に用いるが、「細胞シート工学」の画期的なところは、温度応答性細胞培養器材を用いる事で、従来不可能だった無傷の状態での細胞回収を可能にした事だ。細胞は通常、培養皿で培養する(増殖させる)が、この場合、細胞は培養皿の表面に密着して増殖する。そして細胞を回収する際に皿から剥がすが、その際、トリプシン等のタンパク質加水分解酵素を用いて剥がすため、細胞表面のタンパク質(細胞外マトリクス)が壊れてしまい、本来の生きた細胞とは異なったものになってしまう(傷付けてしまう)。このため、これを再生医療に用いても、きちんと生着できず機能を十分に発揮できない。 一方、同社が開発した温度応答性細胞培養器材は、温度を変える事で細胞が密着している培養面の表面の性質が変わり、表面から細胞が自然と剥がれるため、タンパク質を保持した生の状態に近い細胞をシートとして回収できる(生体組織、臓器に近いものを手に入れる事ができる)。細胞表面のタンパク質(細胞外マトリクス)は、細胞外の空間を充填すると共に、骨格的役割や細胞間結合の足場的役割を担う他、細胞の増殖・分化も制御する。細胞を細胞として機能させるために不可欠な物質であり、患部の修復(再生)に働く。 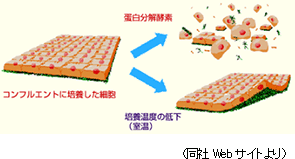
温度応答性細胞培養器材は温度を下げると、温度応答性ポリマーの性質が変わり、細胞シートが剥離するため、細胞表面のタンパク質(細胞外マトリクス)を破壊する事無く回収できる。
従来、細胞の回収に際してトリプシン等のタンパク質加水分解酵素を用いていたが、タンパク質加水分解酵素は細胞間の結合因子や接着因子を破壊し、細胞に大きな傷害を与える。 |
| 市場環境とセルシードのミッション |
 日本では2014年11月25日に医薬品医療機器等法(薬事法が改正され、名称も変更された)や再生医療等安全性確保法が施行され、再生医療の承認に向けた法体系が確立された。医薬品医療機器等法において早期承認制度が導入され、また、再生医療等安全性確保法において細胞培養加工の外部委託が認められた事は世界中の再生医療関連企業が注目するところであり、食道再生上皮シートや軟骨再生シート等、複数の再生医療パイプラインを有する同社にとっても大きなビジネスチャンスである。 (2)再生医療の普及に向けた環境の整備が進展
再生医療元年
医薬品は、1900年頃から化学合成による化合物医薬品の製造が始まり(スタートはアスピリン)、1980年頃には遺伝子組み換えタンパク質による抗体医薬品等の「バイオ医薬品」の市場が生まれ、その後、遺伝子を医薬品として使う「遺伝子医薬品」、がん免疫療法等の生きた細胞を用いる「細胞医薬品」、更には生きた人体組織を治療ツールとして用いる組織医薬品(再生医療)へと技術革新が進んできた(医薬品医療機器等法や再生医療等安全性確保法に示されている再生医療等製品は、再生医療による「組織医薬品」に加え、「遺伝子医薬品」や「細胞医薬品」も含まれている)。「バイオ医薬品」が登場した当時は、技術的な難易度の高さやコスト面での課題に加え、現在のように法整備による後押しも政策的な支援もなかったため(逆に化合物医薬品を前提にした法規制がバイオ医薬品普及の足かせとなった)、市場の確立そのものが疑問視されていたが、30年たった今では医薬品の売上の3割を占めるに至っている。現状では技術面やコスト面でハードルが高い「組織医薬品」ではあるが、安倍政権の成長戦略の一翼を担う分野であり、実際、医薬品医療機器等法による「早期承認制度」や再生医療等安全性確保法による「細胞培養加工の外部受託」の導入等に代表されるように、法改正も含めて普及に向けた環境の整備が進んでいる事等から、「バイオ医薬品」等よりも速いスピードで普及が進むと見られている。 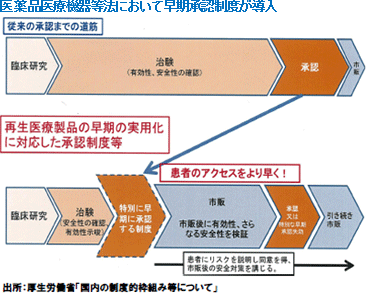 市販後も治療の実績と経過をモニタリングしてデータを積み重ね、最終的に本承認を下す。 (同社資料より) セルシードのミッション
こうした中、同社事業の技術的な基盤である「細胞シート工学」は再生医療等製品の中の組織医薬品(再生医療)を継続的に創出する日本発・世界初のプラットフォーム技術として注目されており、また、「細胞シート工学」を基盤とする同社の事業は、細胞培養(培養器材事業)、細胞シート培養(細胞シート製造・供給)、再生医療による治療(再生医療事業)、と再生医療事業のバリューチェーンを全てカバーしている事が特徴であり、強みである。上記を踏まえて、同社は「セルシードのミッション」として、再生医療の一日も早い実現、細胞シート工学技術の世界への発信、及び安全で品質の高い製品及びサービスの提供による医療の変革への貢献、の3項目を挙げている。このミッションを遂行する事で再生医療産業化の動きを先取りして成長速度を加速させ、これまでの「大学の基礎研究シーズを臨床開発につなげる」ステージの“研究支援会社”から、「収益を創出しながら、再生医療を実現する」ステージの“事業会社”へとステップアップしていく考え。 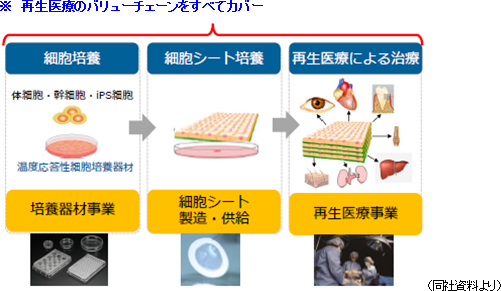 培養器材事業
既に説明した通り、同社の温度応答性細胞培養器材を使えば、培養細胞を生きた状態で回収できる。温度応答性細胞培養器材は、世界で唯一、同社だけが製造・販売している画期的な培養器材だが、これまでは、その販売収益に期待するよりも、大学や研究機関等の提携先開拓のためのツールとしての戦略的な意味合いが強かった。しかし、2014年6月に発足した新経営体制の下では、その高いポテンシャルが見直され、収益獲得の有力な商材と位置付けられている。ラインアップを拡充して多様なニーズを取り込んでいく考え。また。量産体制を整えるべく、製造委託先として大日本印刷(株)と提携した(同社は開発・販売に専念するファブレスメーカーとなった)。
細胞シート製造・培養
再生医療等安全性確保法において細胞培養加工の外部委託が認められた事で、細胞シートの受託製造が可能になった。同社は、まずは自社製品開発を最優先事項としているが、今後、既に豊富な実績を有する細胞シートの製造でアウトソーシングニーズを取り込んでいく考え。
再生医療事業
優先的に自社開発を推進する細胞シート再生医療パイプラインとして食道上皮再生シート及び軟骨再生シートを設定し、当社細胞シート再生医療第1号製品の早期事業化を目指している。食道再生上皮シートについては15/12期下期に国内及びスウェーデンでの治験開始を目指しており、軟骨再生シートについては16/12期に自己細胞の治験を開始したい考え。
|
| 2014年12月の総括 |
|
<新経営体制> 代表取締役社長 橋本せつ子 取締役開発部門長 片山勝見 取締役事業部門長 吉田弘志 取締役戦略推進担当 髙木英二 取締役(社外) 岡野光夫 常勤監査役 小林一郎 監査役(社外) 澤井憲子 監査役(社外) 山口十思雄 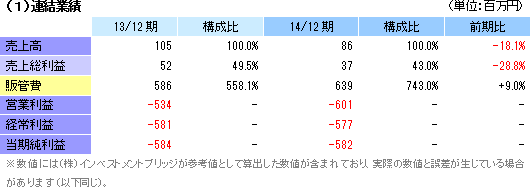 再生医療支援事業については、温度応答性細胞培養器材製品の開発と販売に経営資源を集中せるべく、大日本印刷(株)と提携して製造をアウトソーシングに切り替えた(2014年12月に技術移転と製造設備の移管が完了し、それまでの製造拠点だった富岡事業所を閉鎖した)。今後は器材の需要増にも柔軟かつ迅速に対応できる。また、臨床開発での利用増も見込まれる事から、臨床開発に適した新製品の開発も進めて販売先を広げていく。一方、細胞シート再生医療事業においては、医薬品や医療機器等の安全性向上のための製造業者等への指導及び助言を行う独立行政法人医薬品医療機器総合機構(PMDA)との面談を重ね、細胞シート再生医療製品の早期事業化に向けた準備を進めた。 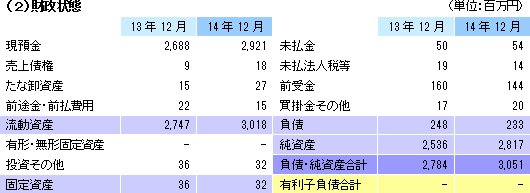 |
| 中期経営計画(15/12期~17/12期) 細胞シート再生医療製品を開発し、世界市場への普及を目指す |
|
【中期経営計画の概要】
2014年11月の再生医療関連新法の施行を踏まえて日本を細胞シート再生医療開発最優先拠点と位置付け、日本での再生医療製品の早期事業化に取り組むと共に、温度応答性細胞培養器材を中心に再生医療関連機器の開発・販売を強化して収益の確保に努める。細胞シート再生医療製品は、まず優先的に自社開発を進めるパイプラインとして、食道上皮再生シートと軟骨再生シートを設定しており、開発した細胞シート再生医療パイプラインについてはグローバル展開も進めていく。
 売上高については、再生医療支援事業の売上のみを織り込んだ。ラインナップの拡充を図ると共に情報提供やカスタマーサービスを強化して、再生医療分野はもとより、細胞を扱う多様な研究機関や企業等にも販路を広げていく。 損益については、治験関連費用、営業強化等による人件費の増加、更には温度応答性細胞培養器材の新製品開発等に伴う開発費用の増加を見込んでいる。また、CPCが16/12期から17/12期にかけて稼働する見込みで、17/12期の営業費用にはCPCの減価償却費も織り込んだが、売上増によるスケールメリットや温度応答性細胞培養器材の大日本印刷(株)への製造移管等による収益性の改善で売上の増加以上に損益の改善が進む見込み。 【事業別の取り組み】
(1)細胞シート再生医療事業 食道再生上皮シート
特徴 :自己口腔粘膜上皮細胞より培養した細胞シート適応症 :内視鏡による食道癌除去後の手術部位治癒及び食道狭窄の防止 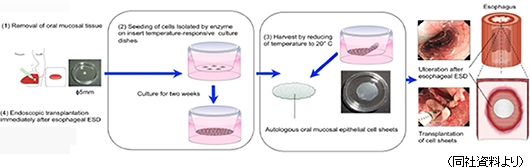 日本での企業治験に向け、食道再生上皮シートの臨床応用を開発した東京女子医科大学先端生命医科学研究所の岡野光夫教授を主幹とする「文部科学省科学技術振興調整費」における「先端融合領域イノベーション創出拠点の形成」プロジェクト(CSTEC)との間では細胞シート再生医療に関する開発基本契約も締結している。15/12期下期には企業治験を開始する予定で、間を置かず、スウェーデンでも企業治験を開始する(欧州での販売承認取得を目指す)。15年3月には、欧州での食道再生上皮シート事業の推進を目的にCellSeed Sweden AB(スウェーデン)を設立した。また、治験と並行して、細胞シート移植用デバイスの開発も進め(食道再生上皮シートの移植手術は高度な手技を必用とするため、専用デバイスの開発で医師の負担軽減を図る)、食道再生上皮シートとのコンビネーション製品として販売していく。尚、温度応答性細胞培養器材製品の製造を委託する大日本印刷(株)はCSTECの参加企業である。 ※ 市場規模
国立がん研究センター対策情報センター及び日本経済新聞「食道がん治療の実力病院・80症例以上の手術ありの47病院」調査を基にした同社の推計によると、2012年の食道癌患者は20,700人で、このうちの約20%(4,140人)の症例が内視鏡による癌切除手術を受けている。この4,000人強が、細胞シートによる治療対象患者と考える事ができる。食道がんは男性に多く、年々、罹患率は上昇しているが、死亡者数は罹患数ほど増えていない事から、食道癌除去後の手術部位治癒及び食道狭窄防止のニーズは増えていると推測できる。
軟骨再生シート
特徴 :自己軟骨細胞及び同種軟骨細胞より培養した細胞シート適応症 :軟骨欠損、変形性膝関節症 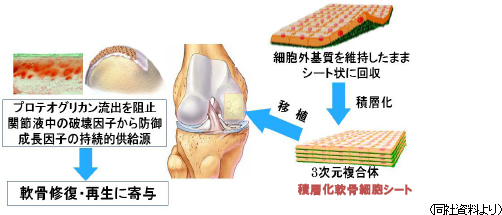 (株)セルシードは、上記自己細胞シートの臨床研究を引き継ぎ、2016年に企業治験を開始できるよう準備を始めていく。 細胞培養施設 自社CPC(細胞培養施設)の設置の検討
食道・軟骨再生シート他パイプラインの細胞シートの製造施設(CPC)の設置を計画しており、エンジニアリング会社との基本設計や場所の選定等の作業が進んでいる。尚、再生医療で使われる細胞はCPCと呼ばれる再生医療新法の新たなガイドライン(GCTP)に準拠したバイオクリーンルームで培養され、CPCの運営は2014年11月施行の「再生医療等の安全性の確保等に関する法律」に準拠した運営が要求される。
(2)再生医療支援事業
新製品開発と新たな販売先の開拓により収益機会を拡大する。新製品は、温度応答性細胞培養器材のラインアップ拡充に加え、細胞シート移植用デバイス等の臨床応用での製品開発を考えている。また、新たな販売先の開拓では、再生医療分野だけでなく、細胞を扱う多様な研究機関や企業等の開拓にも力を入れていく。
【資本政策】
14/12期期初において約30億円の現預金を有しており、中期経営計画を遂行する上での資金的な裏付けはある。ただ、中長期的な観点から資金調達に向けた取り組みを進めていく考え(この中期経営計画期間中に資金調達が実施される模様)。
|
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2025 Investment Bridge Co.,Ltd. All Rights Reserved. |





