ブリッジレポート:(7776)セルシード vol.7
| (7776:JASDAQ) セルシード |
|
||||||||
|
||||||||
企業名 |
株式会社セルシード |
||
社長 |
長谷川 幸雄 |
||
所在地 |
東京都新宿区若松町33-8 アール・ビル新宿 |
||
決算期 |
12月末日 |
業種 |
精密機器(製造業) |
| 項目決算期 | 売上高 | 営業利益 | 経常利益 | 当期純利益 |
| 2011年12月 | 86 | -1,418 | -1,358 | -1,442 |
| 2010年12月 | 66 | -1,204 | -1,002 | -1,009 |
| 2009年12月 | 87 | -785 | -788 | -790 |
| 2008年12月 | 61 | -778 | -644 | -650 |
| 2007年12月 | 40 | -809 | -614 | -616 |
| 2006年12月 | 23 | -672 | -464 | -470 |
| 2005年12月 | 34 | -412 | -336 | -343 |
| 2004年12月 | 53 | -257 | -214 | -215 |
| 株式情報(2/22現在データ) |
|
||||||||||||||||||||||||
|
| 今回のポイント |
 |
| 会社概要 |
|
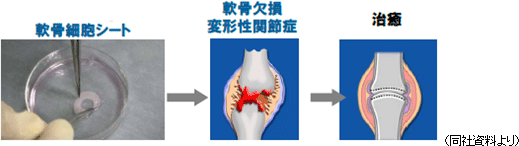
細胞シート再生医療事業
細胞シート再生医療医薬品(各種用途の「細胞シート」)及びその応用製品を販売する。現在、共同研究先と5つの再生医療医薬品パイプライン(新薬候補)の研究開発を進めている。
再生医療支援事業
細胞シート再生医療の基盤ツールである温度応答性細胞培養器材(世界で唯一当社が製造)及びその応用製品を開発・製造(多額の設備投資を必要とする一部の工程は外部委託)し、世界各国の大学・研究機関等に提供している。当事業は細胞シート再生医療事業の提携先開拓のための戦略的な意義をも有し、収益だけを目的とした事業ではない。
 |
| 2011年12月期決算 |
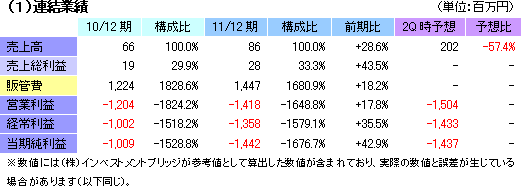 1,358百万円の経常損失ながら、想定の範囲内
再生医療支援事業にかかる売上86百万円を計上。温度応答性細胞培養器材と海外商材の売上(仕入販売)が共に計画を上回った。一方、細胞シート再生医療事業は売上計上に至らなかったが、欧州角膜再生上皮シートが第2四半期(4-6月)に上市への最終段階(薬事審査)に入った他、その他の全てのパイプラインがヒト臨床段階に入った。損益面では、経費節減で一定の成果をあげたものの(研究開発費を除く販管費:615百万円→579百万円)、研究開発費が前期の609百万円から867百万円に増加(欧州角膜再生上皮シート開発費用など約200百万円が次期に持ち越しとなったが)したため営業損失が拡大。補助金収入の減少で(226百万円→55百万円)営業外損益が悪化した他、決算処理に伴う減損損失72百万円など79百万円を特別損失に計上した(前期の特別損失は3百万円)。 尚、12月に業績予想を修正しており、売上・利益共に修正値に沿った着地となったが、第2四半期決算発表時の予想との比較では、細胞シート再生医療事業において見込んでいた角膜再生上皮シートの米国展開に伴うEmmaus Medical 社からの一時金150万米ドル(契約締結当時の為替レート換算で127百万円)の入金が12/12期以降にずれ込んだため売上が大きく下振れした。一方、損失が予想を下回ったのは、欧州での角膜再生上皮シート開発費用など約200百万円が次期に持ち越しとなったため。 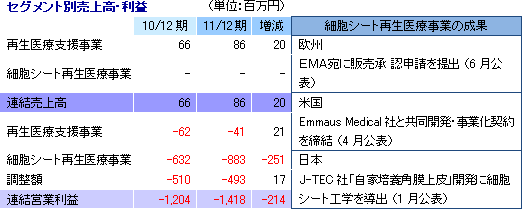 (2)細胞シート再生医療事業の進捗状況
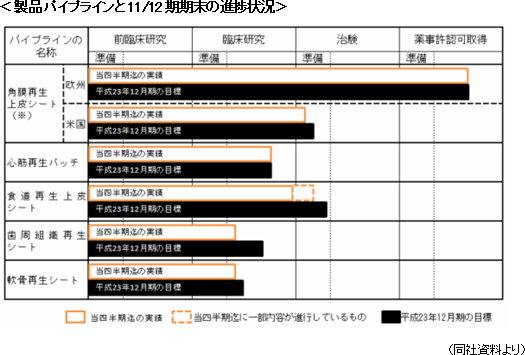
①欧州角膜再生上皮シート
11年5月31日に欧州医薬品庁(European Medicines Agency:EMA)宛に承認申請書類を提出し、6月7日にEMAより申請書類の受領確認が到着した。形式面での不備がない事が確認され、現在、EMAが申請書類の内容について審査を進めている。尚、欧州(EU)の薬事規制では、同社の角膜再生上皮シートのような再生医療医薬品など「先端医療医薬品(ATMP = Advanced Therapy Medicinal Product)」については、各国の審査当局ではなくEMA(本部:英国ロンドン) が薬事審査を行う。EMAの薬事審査を経て欧州委員会の販売承認を得た医薬品は、5億人以上の総人口を擁する欧州30ヶ国(=EU加盟27ヶ国+EEA/EFTA 加盟3ヶ国)での販売が認められる。また、元武田薬品グループのオーストリア法人社長として実績を残したHelmut Hasibeder 氏をグループ欧州地域総責任者に任命した他、欧州販売・マーケティング体制に関する戦略的自由度の見直しに着手し、この一環として、Clonmel Healthcare Limited 社との販売提携を解消した。一方、フランスでの人道的使用(欧州主要各国の許可に基づくヒト患者への薬事承認前医薬品の提供)については、現地の規制強化を踏まえ一旦中止した(後述)。 ②その他のパイプライン
欧州角膜再生上皮シート以外のパイプラインの研究開発も着実に進捗しており、角膜再生上皮シートの米国展開を含めた5つのパイプライン全てがヒト臨床段階に入った。
   (4)11/12期に取得した特許とその概要
同社事業に関わる主要プロセスは、"細胞の採取・分離"、"細胞シート工学による組織構築"、及び"移植治療"の3つのプロセスに分かれるが、11/12期は、"細胞の採取・分離"プロセスで必要となる新型器材「高密度細胞アレイ用基板」にかかる特許、"細胞シート工学による組織構築"プロセスにかかる特許6件(日本4件、欧州2件)、及び"移植治療"プロセスで必要となる細胞シート利用「癌組織モデル作製技術」(細胞シート利用評価システム)にかかる特許の計8件の特許を取得した。取得した特許の概要は次の通り。
 また、細胞シート利用「癌組織モデル作製技術」は、担癌動物を得る際に特定の領域に特定のサイズの癌細胞を作る技術である(意図した場所に、意図した大きさの癌細胞を作る事ができる)。 |
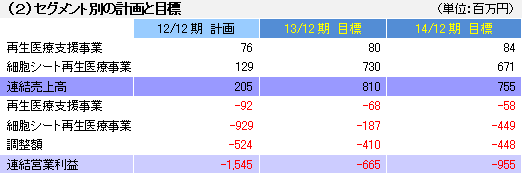
| 3ヵ年(2012年12月期~2014年12月期)事業計画 |
  再生医療支援事業
販促活動及び商品ラインアップの拡充等で売上高の増加に注力すると共に、引き続き新製品の研究開発を進める。
細胞シート再生医療事業
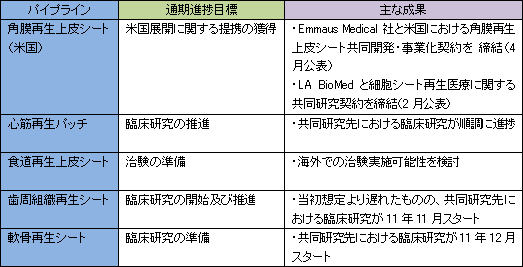
12/12期はEmmaus Medical 社から米国角膜再生上皮シート事業にかかる提携一時金を受領する予定である他、欧州で角膜再生上皮シートの人道的使用が始まる予定で、これに伴う提供対価の獲得が見込まれる。ただ、欧州角膜再生上皮シート事業に関しては、他の施設で進めている治験の中間データ(短期データ)を付与してデータを補強する必要が生じたため販売開始は13/12期になる見込み。この他、心筋再生パッチが今期中に治験に、食道生成シートが治験準備(13/12期に治験開始予定)に、それぞれ入る予定。歯周組織再生シート(14/12期に臨床研究が終了する予定)と軟骨再生シートについては臨床研究が続く。13/12期については、心筋再生パッチの研究開発に伴う提携一時金の獲得や、(条件付)販売承認(条件付:例えば1年毎などの報告が必要)の取得による欧州での角膜再生上皮シート販売収入の獲得が見込まれる。14/12期の売上が減少するのは、提携一時金の獲得を見込んでいないため。 尚、人道的使用とは、欧州主要各国の許可に基づくヒト患者への薬事承認前医薬品の提供であり、有償で提供する事が可能である。  (3)当面の財務戦略
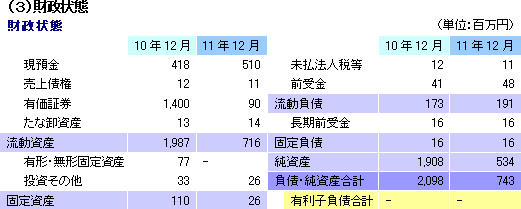
11/12期は、投資有価証券を現金化する事で必要な資金を確保したが、新株予約権を活用した資金調達枠(野村エクイティライン1,000百万円、残額900百万円)を設定する等、12/12期以降の資金手当てのための施策も講じた。12/12期は、上記の野村エクイティラインの活用に加え、Emmaus Medical社からの提携一時金(2本計1,000万米ドル)の受領を予定している。13/12期は、心筋再生パッチの共同研究開発にかかる提携一時金(500百万円)が見込まれており、この他、更なる提携の拡大や公的補助金・助成金の獲得で資金の積み増しを図る考え。 上記のうち、確定もしくはほぼ確定している野村エクイティライン、Emmaus Medical社からの提携一時金、及び心筋再生パッチの共同研究開発にかかる提携一時金に、現在の手元資金を加えると約2,800百万円となり、13/12期にかけての資金を賄う事が可能で、14/12期分についても大半は手当が済んでいると考える事ができる。 |
| 11/12期決算及び今後の事業計画のポイント |
|
人道的使用に関する計画の修正については既に説明したとおりで、フランスの国内事情によるもの。新しい事業を手掛ける場合、こうした不測の事態は珍しい事ではない。事業計画に多くを織り込んでいなかったため現状では影響は軽微で、また、角膜再生上皮シートに問題があった訳ではなく、事業機会が無くなった訳でもない。 欧州角膜再生上皮シートの収益化の遅れ(薬事許認可取得の遅れ)については、「再現性」が焦点となっているようだ。簡単に言うと、「角膜再生上皮シートの治験は、リヨン国立病院において眼科の権威が実施したものだが(だから治験が順調に進んだ)、他の施設でも同様の結果を得られるのか」という見方もできる。薬事許認可の審査は、書類提出後に当局から質問を受け、同社(申請者)がこれに回答していく事で審査が進められるが、同社は当局からの質問を受けて、当局が「再現性」について疑問を持っていると感じたようだ。このため、多施設で治験を実施し、この結果を質問の回答に添付したい考え(少ない施設で治験を行うと症例数の確保に時間を要するが、多施設で行えば、1施設の症例数が少なくて済むため短期間でデータを集める事ができる)。ただ、質問に対する回答を受けるまで審査が止まるため、回答に時間を要すれば、当初の見通しよりも審査期間が長くなる。要するに、方向性が変わった訳ではなく、前例の無い再生医療の分野であるだけに当局も慎重であり、予想以上に生みの苦しみが大きいと言う事。 角膜再生上皮シートの米国展開にかかる提携一時金の受取の遅れについても特に問題があった訳ではない。Emmaus Medical 社への技術移転と欧州での薬事申請書類の対価として、先ず150万ドルを受け取る予定であったが、米国での薬事申請に必要となる動物への移植実験のデータ等も加える必要が生じた。このデータを用意するために一時金の受け取りが遅れたが、既に動物への移植実験が終了しているため(モデル動物の作製が完了し、現在観察中)、早い時期に支払いを受ける見込み。また、残りの850万ドルについても、製造拠点に関する事項など事業開始に必要な情報交換が必要となるため若干遅れるものの、今12/12期中に受領できる見込み(12/12期の計画には織り込まれていない)。 この他、心筋再生パッチの研究開発に伴う提携一時金についても、現時点では受領時期が確定している訳ではない。 |
|
| 本レポートは情報提供を目的としたものであり、投資勧誘を意図するものではありません。また、本レポートに記載されている情報及び見解は当社が公表されたデータに基づいて作成したものです。本レポートに掲載された情報は、当社が信頼できると判断した情報源から入手したものですが、その正確性・完全性を全面的に保証するものではありません。当該情報や見解の正確性、完全性もしくは妥当性についても保証するものではなく、また責任を負うものではありません。 本レポートに関する一切の権利は(株)インベストメントブリッジにあり、本レポートの内容等につきましては今後予告無く変更される場合があります。 投資にあたっての決定は、ご自身の判断でなされますようお願い申しあげます。 Copyright(C) 2025 Investment Bridge Co.,Ltd. All Rights Reserved. |





